

图1
INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
mRNA疫苗的首次出现可以追溯到20世纪末和21世纪初,但其在疫苗领域的实际应用和突破性进展主要集中在近年来,特别是在应对COVID-19大流行时期。目前,mRNA疫苗在各个领域的研究进展迅速,为传染病、肿瘤等疾病的治疗和预防带来了新的机遇和希望。
近日,国际顶刊《Science》发布了一篇来自美国Harvard, MIT和麻省总院附属下的Ragon研究所的Facundo D. Batista 团队、William R. Schief 团队联合Scripps 研究所Andrew B. Ward 团队的研究论文,展示了又一重磅的mRNA疫苗,为mRNA疫苗技术在HIV预防中的应用开辟了新天地。(图1)
研究意义
Significance
研究人员旨在利用mRNA技术诱导生成针对多种HIV亚型至关重要的广谱中和抗体(bnAbs)前体,为种系细胞靶向激活(germline targeting,GT)和递进式免疫策略在HIV疫苗开发上的可行性提供了证据。通过动物模型,研究者成功诱发了对HIV bnAbs的特异性免疫反应,开辟了开发有效HIV疫苗的新策略。
KEYWORDS
•
✦
关键名词
✦
•
生发中心(Germinal Centers,GCs)
是脾脏和淋巴结中B细胞受抗原刺激后发生增殖、分化和抗体类别转换的特殊微环境。在适应性免疫反应(特别是在体液免疫)中扮演着至关重要的角色:
1 | B细胞的亲和力成熟:在GCs内,B细胞通过与抗原的持续接触、T细胞的帮助以及与其他B细胞的竞争,经历体细胞超突变(Somatic Hypermutation, SHM)和抗体可变区的亲和力成熟,从而产生对抗原具有更高亲和力的抗体。 |
2 | B细胞的选择和分化:GCs提供了一个环境,使得具有高亲和力BCR(B细胞受体)的B细胞得以存活和增殖,而低亲和力的B细胞则被淘汰。此外,GCs还促进B细胞向浆细胞或记忆B细胞的分化。 |
3 | 免疫记忆的形成:GCs有助于形成长期免疫记忆,其中记忆B细胞可以在再次遇到相同抗原时迅速响应,而浆细胞则负责产生大量的抗体以应对当前的感染。 |
4 | 抗体类别转换:在GCs,B细胞还可以经历抗体类别转换(Class Switch Recombination, CSR),改变其产生的抗体类型(如从IgM转换为IgG),以适应不同的免疫需求。 |
RESULTS
•
✦
研究结果
✦
•
一、
N332-GT5三聚体蛋白有效激活BG18前体
BG18是针对HIV-1病毒包膜蛋白(Env)上V3环上的甘露糖结构的一种人源化抗体。这种抗体能够有效地中和多种HIV病毒株,是一种bnAbs。研究者利用人源化小鼠模型BG18 gH,来研究疫苗免疫原N332-GT5蛋白三聚体诱导激活的免疫生物学。
通过流式细胞术分析,发现在未免疫的小鼠中,17.4%的naïve B细胞能够特异性结合N332-GT5,远高于野生型(WT)小鼠。此外,通过表位特异性Fab与GT5和其前身GT2的解离常数(Kd)测量,发现GT5与Fab的结合亲和力远高于GT2。这表明人源化的naïve B细胞在BG18gH小鼠模型中能够结合GT5,并且具有更高的亲和力。通过采用转移的CD45.2 KI BG18gH或WT小鼠到CD45.1 WT动物中,研究者们进一步证实了GT5三聚体蛋白能够特异性地激活BG18 iGL前体,并且这种激活在低频率的BG18前体中也能高效发生。(图2)
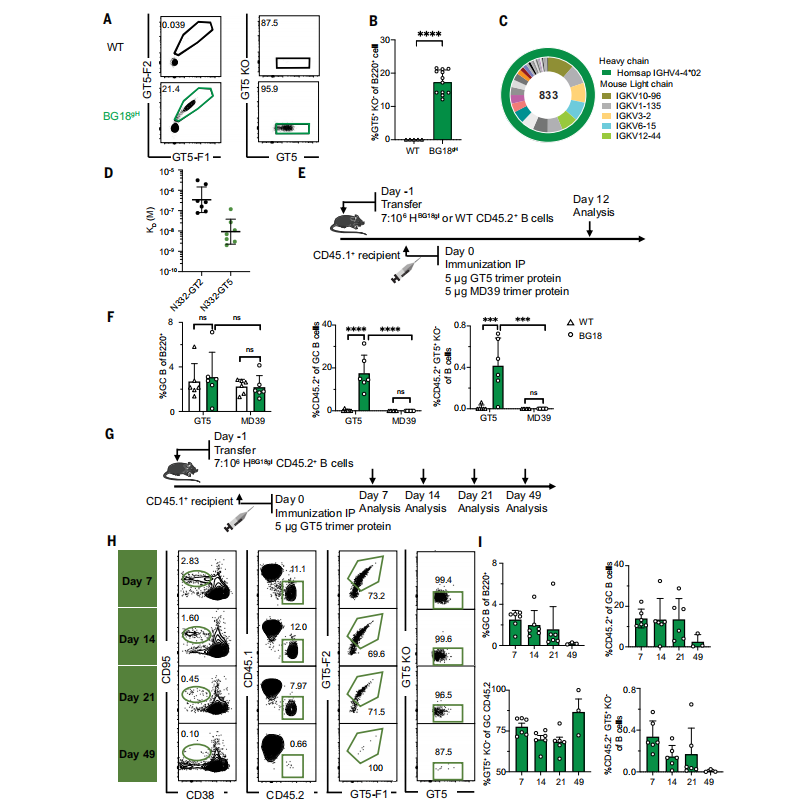
图2
二、
N332-GT5蛋白三聚体驱动BG18前体亲和力成熟
研究者们发现,通过GT5三聚体蛋白免疫的BG18gH小鼠在16和42天检测点时,血清IgG滴度显著高于对照组。通过负染色电子显微镜多克隆表位图谱(nsEMPEM)分析,发现BG18和WT小鼠的血清多克隆抗体(pAb)都接近GT5的V3-糖蛋白表位,但采用了不同的结合姿态。
此外,通过冷冻电镜EMPEM(cryoEMPEM)获得的高分辨率结构表明,BG18 pAbs通过长的HCDR3与GT5蛋白在V3环底部的保守Gly-Asp-Ile-Arg (GDIR)基序接触,而WT pAb-GT5的相互作用集中在V1环和工程化的糖蛋白空缺处。
研究者们还观察到在GCs中,GT5免疫后42天的B细胞展示了持续的体细胞超突变(SHM),这表明GT5三聚体蛋白不仅激活了稀有的BG18gH前体,还促进了它们的亲和力成熟。(图3)
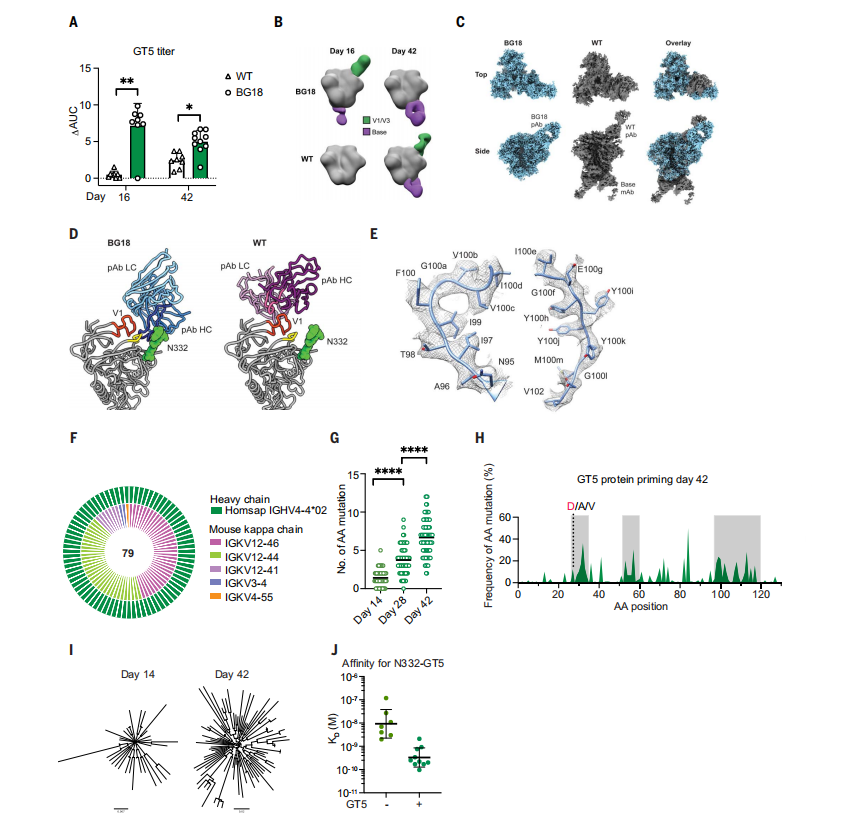
图3
三、
增强免疫原B11和B16
研究者们设计了两种增强免疫原B11和B16,它们旨在最小化与V1环直接的鼠抗体的交叉反应。
研究发现,在N332-GT5启动后,BG18类前体抗体获得了对B16和B11增强剂的可检测亲和力,尽管这些亲和力增益远小于GT5。在GT5三聚体蛋白免疫后56天,小鼠接受了5mg的B11或B16三聚体蛋白增强免疫,分析在增强后65天进行。增强后的GCs比仅启动的动物大几倍。这表明B11和B16增强剂能够显著增加GCs的大小,同时保持BG18前体的参与。(图4)
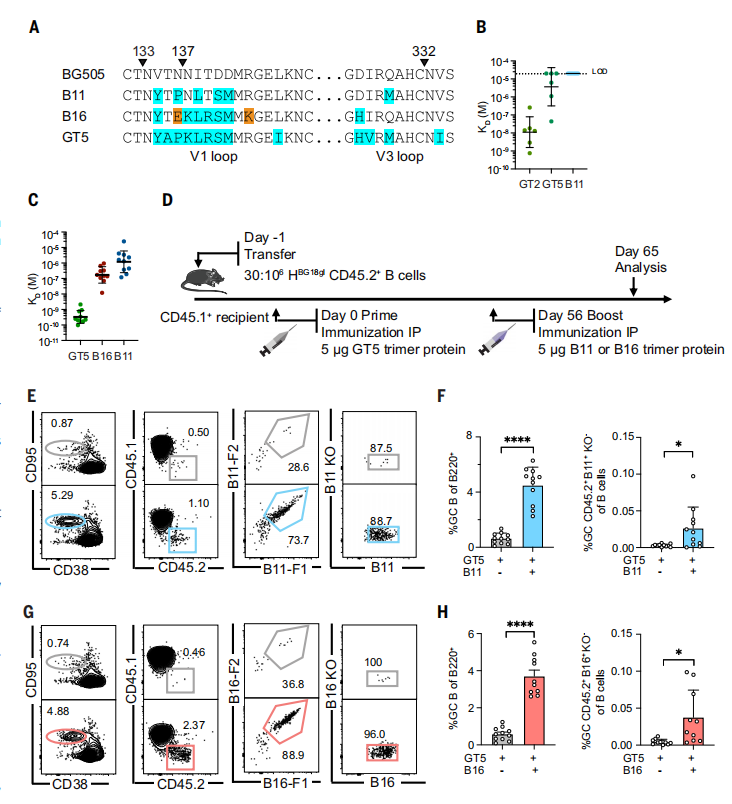
图4
四、
B11和B16促进BG18gH B细胞发生广泛的SHM
研究者们在B11和B16蛋白增强后35天(即启动后77天)分离了B11和B16 CD45.2结合物,用于B细胞受体(BCR)测序。观察到在CDRs中积累的突变,并且通过增强的SHM推动了增强细胞在第77天的显著多样化。这种多样化导致了大约一半的Fab测量出在B11增强后对B11的亲和力增加,以及在B16增强后对B16的类似部分Fab的亲和力增加。(图5)
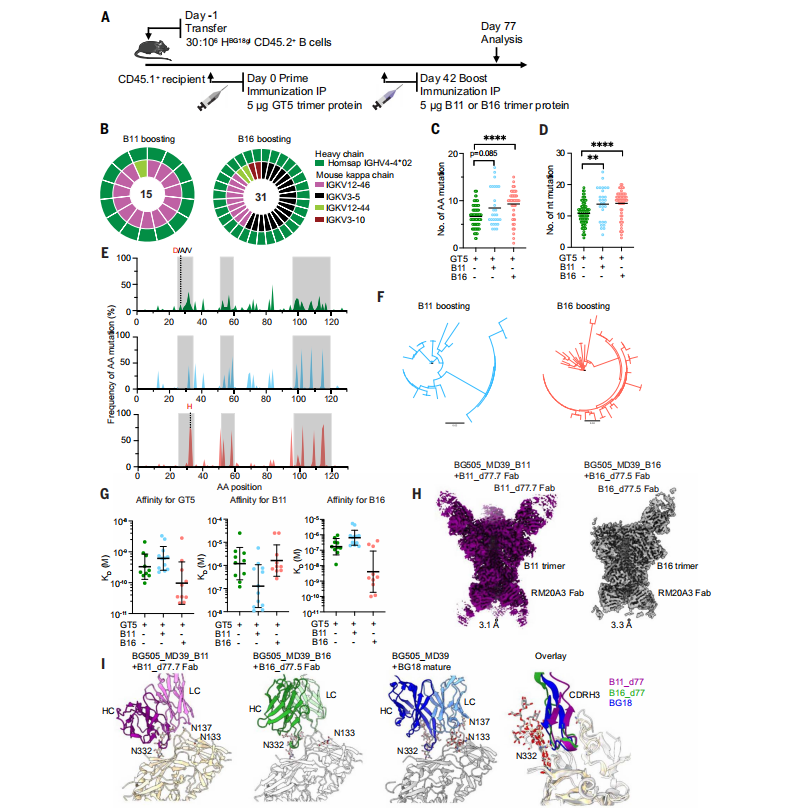
图5
其中,"Fab"指的是抗体的抗原结合片段(Fragment of antigen binding),是抗体识别并结合特定抗原表位的关键部分。Fab片段可以作为免疫反应的一部分,通过与抗原结合,调节免疫细胞的活动,影响免疫应答的强度和类型,抗体的特异性主要取决于Fab片段的可变区结构。
五、
N332-GT5前体激活机制
gp151是指的HIV-1病毒包膜糖蛋白 (Env)的gp120和gp41两个亚基。在疫苗开发中,gp120或gp140常被用作免疫原,目的是激发宿主产生针对HIV-1病毒的中和抗体。研究人员使用先前报道的膜结合gp151三聚体格式,进行了10mg GT5膜结合三聚体mRNA的免疫实验,并在14、28和56天检测点分析了响应。
GT5-mRNA疫苗产生了强大的GCs,这些GCs一直持续到56天检测点。GCs由大量CD45.2 BG18gH B细胞组成,这些细胞在56天时有所下降。大约一半的CD45.2s在所有分析日期的GCs中是表位特异性结合物。通过mRNA作为膜锚定免疫原传递的GT5触发了强烈且持久的体液反应,其免疫原性与蛋白三聚体相似,但可能更可取。它产生了持久的GCs和类似的突变图谱,且负染色电子显微镜多克隆表位图谱(nsEMPEM)结果表明与碱基的脱靶结合较少,这是疫苗设计中的一个积极结果,有助于确保疫苗引发的免疫应答尽可能接近理想状态。(图6)
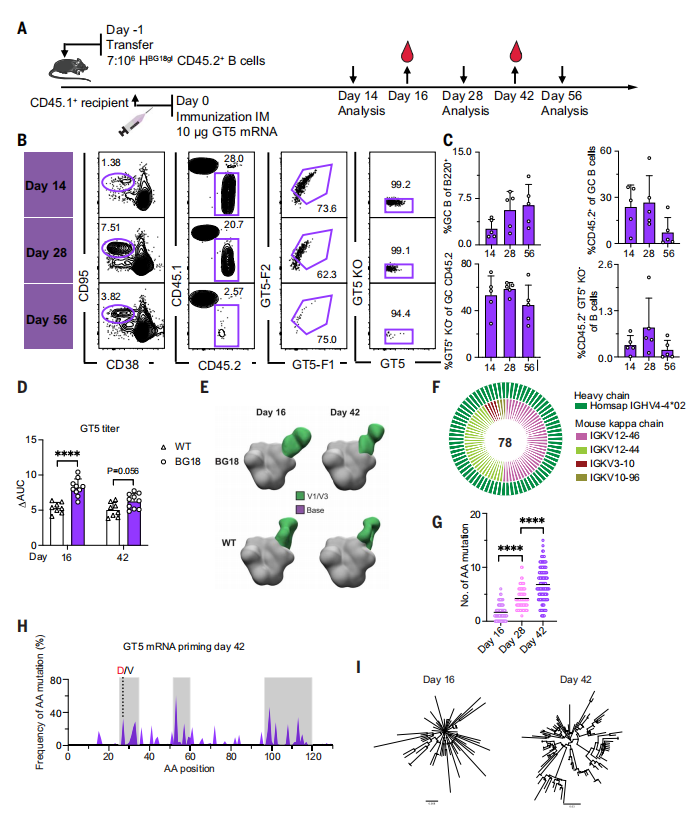
图6
六、
mRNA启动-mRNA增强方案效果
在确定了B11和B16蛋白三聚体作为GT5后增强免疫原的有效性以及GT5 mRNA启动相对于GT5蛋白三聚体的免疫原性之后,接下来的研究是发掘膜锚定三聚体对mRNA递送的启动-增强方案的反应,研究人员建立了与蛋白增强剂相同的高频受体模型。发现在增强后的第58天和第78天,增强的GCs比仅启动的动物大得多,并且维持到第78天。因此,mRNA-LNP是引物-增强方案的有效替代递送系统。(图7)
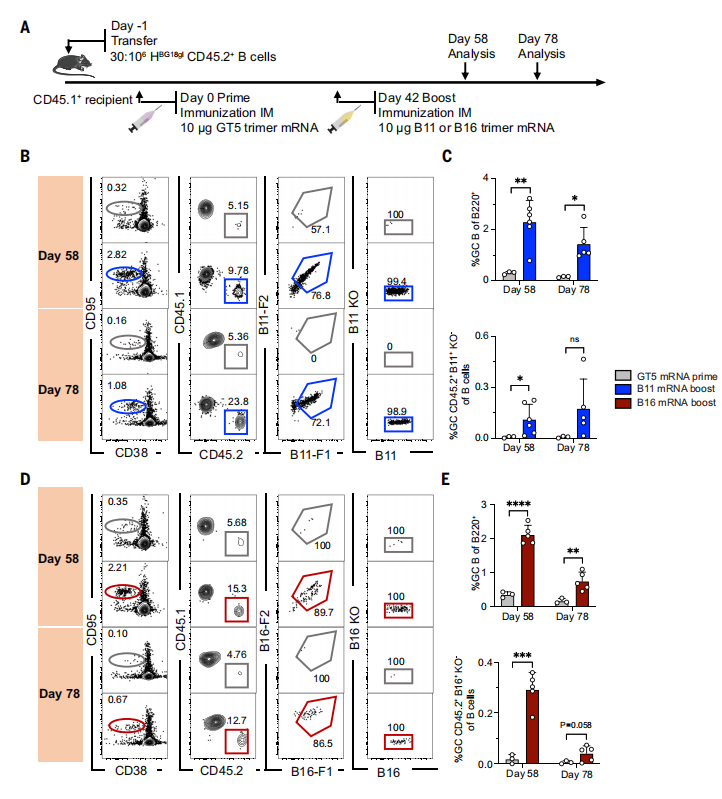
图7
为了表征mRNA引物- mRNA增强序列驱动的多样性,研究人员在增强后36天(即第78天)分离了CD45.2+ B细胞表位特异性结合物,用于单细胞BCR测序。发现LC的使用被限制在一组小鼠κ链中。HCs表现出比GT5 mRNA启动单独时更高的SHM频率,并且CDRs富集了氨基酸突变。此外,已知的bnAb HCDR1突变之外,其他极性和带电残基的突变在HCDR1中也很常见。研究人员还测试了两个在B11 mRNA增强后36天分离的抗体(B11_d78.08和B11_d78.10),它们对B11有很高的亲和力,测试了它们中和V1环修饰的假病毒的能力。这些抗体能够中和两种V1修饰的假病毒,但它们不能中和WT BG505_T332N病毒,表明mRNA增强的抗体是功能性的,但还没有获得中和完全原生假病毒所需的SHM质量,原生假病毒的中和将需要进一步的BCR修饰。(图8)
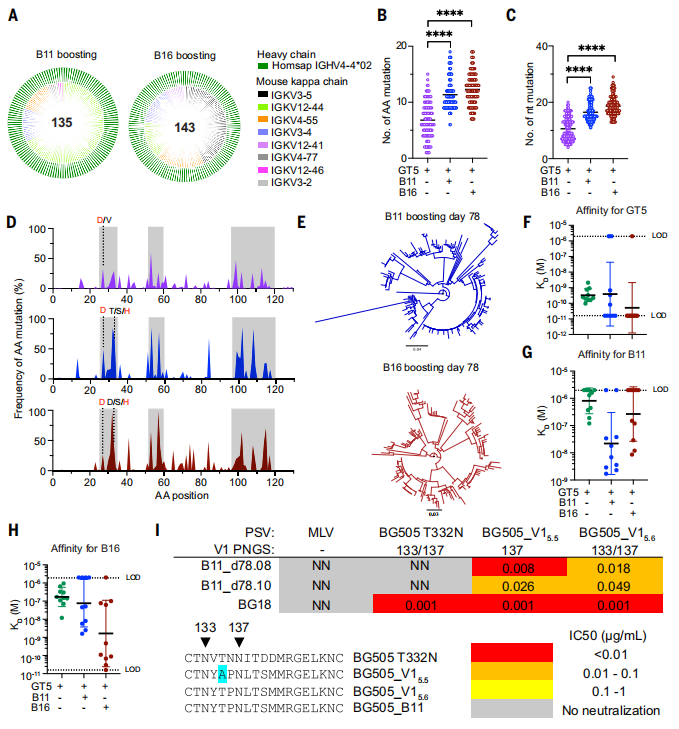
图8
DISCUSSION
•
✦
研究讨论
✦
•
HIV的遗传多样性以及广泛中和抗体(bnAbs)的共同进化事件是疫苗开发的主要障碍,此次研究不仅证实了mRNA疫苗平台的强大功能和应用灵活性,也为将来的医疗突破带来希望。
在这项研究中,研究人员评估了GT免疫原N332-GT5的效力,还评估了它的首次增强免疫原候选物B11和B16。无论是以蛋白质三聚体还是mRNA-LNP的形式传递,GT5都可以有效地启动免疫反应。且mRNA-LNP与蛋白质三聚体相比,可能减少了对非目标表位的结合,表明mRNA-LNP可能是解决HIV疫苗开发中一些主要挑战的有效策略,强调了其在HIV疫苗开发中的潜力,并指出了未来研究的方向。
参考文献
[1] Zhenfei Xie et al. ,mRNA-LNP HIV-1 trimer boosters elicit precursors to broad neutralizing antibodies.Science384,eadk0582(2024).DOI:10.1126/science.adk0582
PROFILE
Facundo D. Batista
麻省理工学院和哈佛大学拉贡研究所的第一任副主任和科学主任,也是麻省理工学院生物学的第一位 Phillip T. 和 Susan M. Ragon 教授。
2016 年加入了 Ragon 研究所,开始了一项新的研究计划,将他在 B 细胞和抗体反应方面的专业知识应用于疫苗开发。他在该研究所的部分工作涉及对具有人源化BCR的小鼠进行基因工程。使用 CRISPR/Cas9 进行了重大技术创新,大大简化建造动物模型的流程,这些动物模型可用于候选疫苗的快速临床前测试。
END
文案 | 姜笑南
排版 | 姜笑南
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
