

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
呼吸复合体I(Complex I,CI)作为哺乳动物线粒体氧化磷酸化的核心驱动者,是电子流入线粒体呼吸链的首要门户。在缺氧条件下,复合体I的失控催化可能导致氧化应激和细胞损伤。然而,在缺血状态下,CI能够从快速、可逆的催化状态转化为一种休眠状态,这种转换在再氧合时展现出显著的保护作用。
研究目的
Objectives
本研究旨在深入探究复合体I在缺血条件下由激活态至休眠态的分子转变机制,以及如何通过膜相互作用调节这一转变,进而在再氧合过程中保护细胞免受损伤。
METHODS
•
✦
研究方法
✦
•
研究亮点
本研究结合了蛋白质纯化与脂质体构建技术,通过胆素金属络合物重构形成完整的线粒体内源铁蛋白CI-PLs(图1A)。利用功能化氧化石墨烯(GO)载网,我们进行了CI-PLs的冷冻电子显微镜分析(图1B)。此外,通过蛋白质活性分析以及质谱分析技术,我们详细研究了CI-PLs的活性状态(图1C)。 | |
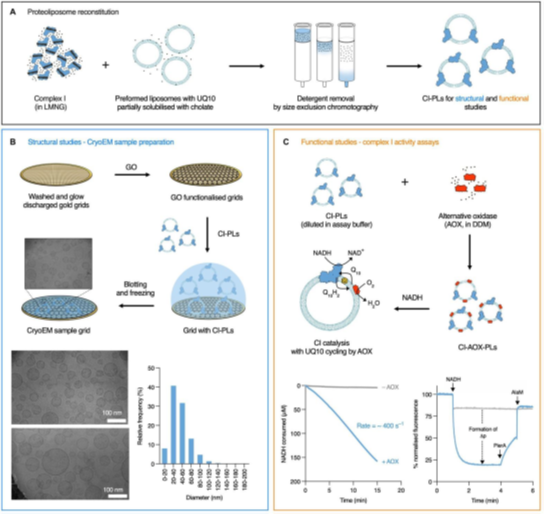 图1 结合生化,生物物理和冷冻电镜策略研究复合物I |
FINDINGS
•
✦
研究发现
✦
•
基本信息描述
1 | 复合物I 的膜上构象状态 通过高分辨率的冷冻电镜技术,我们观察到复合物I在磷脂双分子层小泡中存在“开放”与“关闭”两种状态(图2A-C)。这两种状态由水溶性结构域和跨膜结构域之间的旋转连接区域相关联。我们的研究强调了去垢剂对结构状态的影响,并揭示了极端开放“松弛”状态是DDM诱导的伪影。 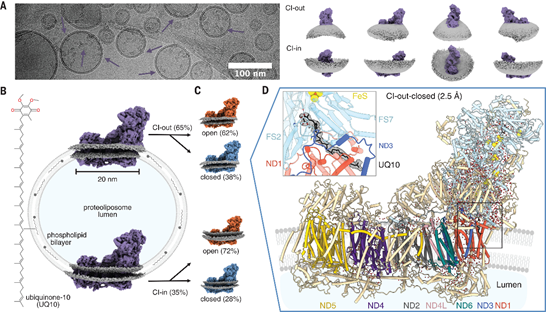 图2 蛋白脂质体复合体 I 高分辨率结构 |
2 | 不同构象下的功能差异 冷冻电镜和生化分析显示,闭合状态代表活性休眠状态,准备好进行催化,而开放状态则处于休眠的去活性状态。缺血组织中复合物I样本的状态分布反映了其在缺乏底物时正经历去活性转变的瞬时过程(图3)。 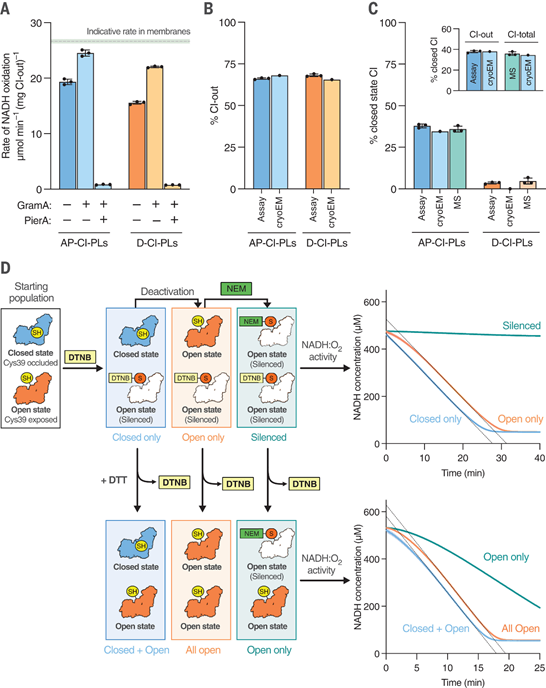 图3 CI-PLs中复合体I 的生化性质 |
3 | 泛醌-10结合位点的复杂性 进一步的结构和功能分析揭示了泛醌-10结合位点在复合物I中的调控作用。闭合状态支持具有明确泛醌结合位点的活性催化,而开放状态虽结构有所不同,但都代表酶的去活性形式(图4)。 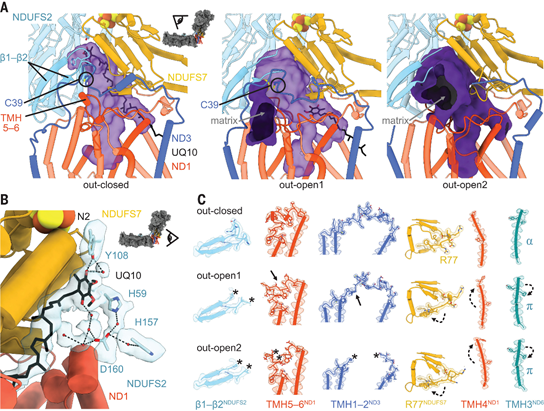 图4 CI-PLs中复合体I 的局部结构细节 |
4 | 复合物I失活的结构基础 复合体I从闭合状态向开放状态的转变受到膜环境的显著影响。在闭合状态下,膜蛋白亚基通过相互作用保持稳定,形成有效的催化结构。而在开放状态下,亲水性域绕膜域旋转导致膜蛋白亚基扩展,失去催化活性。这种结构变化受到NDUFA9和其他脂质相互作用的调控(图5)。 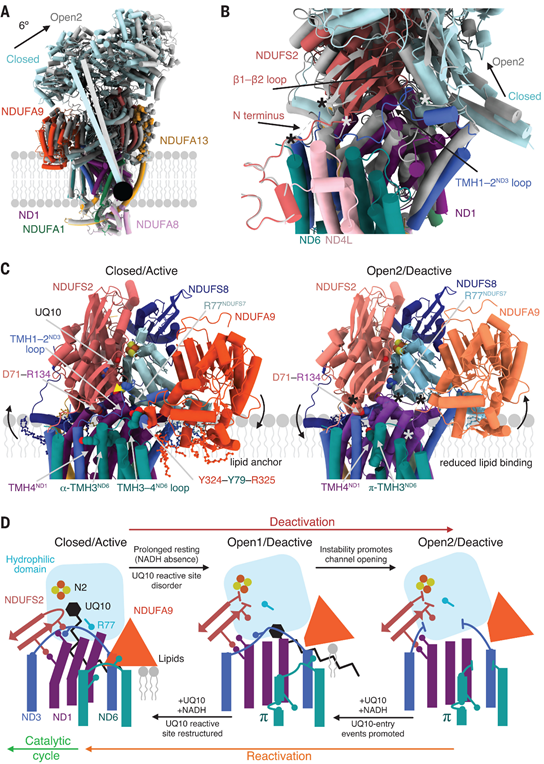 图5 在封闭(激活)和开放(失活)静息状态之间的结构转换 |
DISCUSSION
•
✦
研究讨论
✦
•
在蛋白质脂质体系统中,复合物I的结构转变对其功能和生理影响至关重要。CI在闭合状态下完全装载泛醌-10,展现其催化准备性。缺血期间的开放状态被视为休眠状态,需重新激活以恢复催化活性。这一发现与先前的某些推测相悖,为理解CI的催化机制提供了新视角。
通过冷冻电镜等技术观察到的结构变化,为CI的催化机制提供了重要结构基础。研究还强调了膜环境中结构分析的重要性,以及将结构分析与功能分析相结合的必要性,为未来深入探索复合物I的催化中间体提供了重要方向。
参考文献
Daniel N. Grba et al.,Molecular mechanism of the ischemia-induced regulatory switch in mammalian complex I.Science384,1247-1253 (2024).DOI:10.1126/science.ado2075
PROFILE
Judy Hirst
剑桥大学MRC线粒体生物学单位的生物化学教授

Hirst教授于2018年当选为英国皇家学会(FRS)院士,并荣获英国皇家化学会的跨学科奖。2019年,她当选为医学科学院院士。2020年,她获得Keilin纪念讲座和奖章,以表彰她在揭示复杂氧化还原酶中能量转换机制方面的杰出贡献,尤其是在哺乳动物呼吸复合体I方面的工作。她通过电子冷冻显微镜技术成功解开了这一关键线粒体氧化还原酶的结构之谜。
END
文案 | 晶体转业
排版 | 晶体转业
审核 | 晶体转业
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
