

图1
INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background

紫外线(UV)辐射对细胞有多种危害:会损害DNA,引发DNA损伤反应(DDR);会损伤细胞膜,引起细胞膜的氧化应激;同时也会损害RNA,触发转录组范围的核糖体碰撞并引发核糖毒性应激反应(RSR)。
细胞的生存能力,与其本身在变化的环境中的反应能力息息相关。细胞对环境扰动的反应依赖于调节基因表达和激活应激反应程序,以恢复体内平衡的信号级联反应。当压力无法解决时,就会触发程序性细胞死亡,以防止功能失调的细胞对生物体造成伤害。
此前,紫外线辐射诱导的DDR 和 RSR 对确定核酸损伤后细胞命运的相对贡献尚不清楚。来自约翰霍普金斯大学和纪念斯隆·凯特琳癌症中心的研究人员,在《Cell》上发表最新研究成果,阐明了UV辐射导致细胞死亡的机制,即通过激活RSR中的ZAK激酶,而不是传统的DDR途径。(图1)
研究意义
Significance

研究人员使用时间分辨的磷酸化蛋白质组学、化学遗传学、单细胞成像和生化方法来创建响应紫外线损伤的细胞中激活信号转导事件的时间图谱。确定了调节 ZAK 介导的细胞凋亡的两个负反馈模块:
1 | GCN2 激酶激活限制核糖体碰撞并减弱 ZAK 介导的 RSR; |
2 | ZAK活性导致磷酸降解标记(Phosphodegron)的自磷酸化及随后的降解。 |
这些机制将 ZAK 的活性调整到碰撞水平,以建立稳态、耐受性和死亡机制,揭示其作为核酸损伤细胞哨兵的关键作用。(图2)
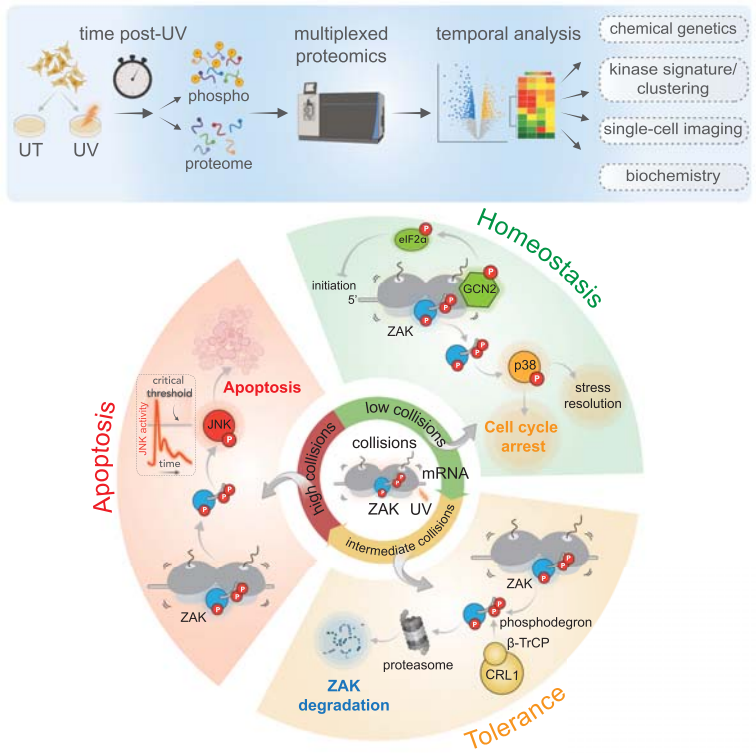
图2
METHODS
•
✦
研究方法
✦
•
研究亮点
1 | 时间分辨的磷酸化蛋白质组学 分析细胞在UV辐射后不同时间点的磷酸化蛋白质表达变化,以揭示信号传导事件的时间动态。 |
2 | 化学遗传学 使用小分子化合物来特异性地激活或抑制细胞内的特定信号通路,从而研究这些通路在细胞应激反应中的作用。 |
3 | 单细胞成像 在单细胞水平上观察和分析细胞对UV辐射的响应,如核糖体碰撞和信号传导途径的激活 |
4 | 流式细胞术 用于分析细胞周期分布、DNA含量和细胞凋亡等。 |
5 | 共免疫沉淀 研究蛋白质之间的相互作用和复合体的形成。 |
FINDINGS
•
✦
研究发现
✦
•
一、
细胞对UV辐射的即时早期反应

研究人员先是评估了紫外线辐射诱导核糖体碰撞的能力。与使用经典激动剂(如延伸抑制剂茴香霉素 ANS)导致的持续应激相比,UV辐射使他们能够观察细胞从短暂的核糖体应激中恢复时信号响应的时间动态。核糖体蛋白eS10泛素化增加,这是核糖体碰撞的特征。
实验结果表明,UV辐射后,ZAK激酶的激活以及随后p38和JNK的激活,是早期细胞周期停滞和细胞凋亡的关键驱动因素。通过时间分辨磷酸化和总蛋白质组学,创建响应紫外线损伤的HaCaT细胞(一种非致瘤性人角质形成细胞系)中全磷酸化事件的时间图谱,研究人员观察到UV辐射诱导的核糖体碰撞在几分钟内累积,并在几小时内被清除。紫外线应激细胞中 p38、JNK 和 DDR 激酶的顺序激活,强调了核糖体介导的信号转导在最早的紫外线反应中占主导地位。(图3)
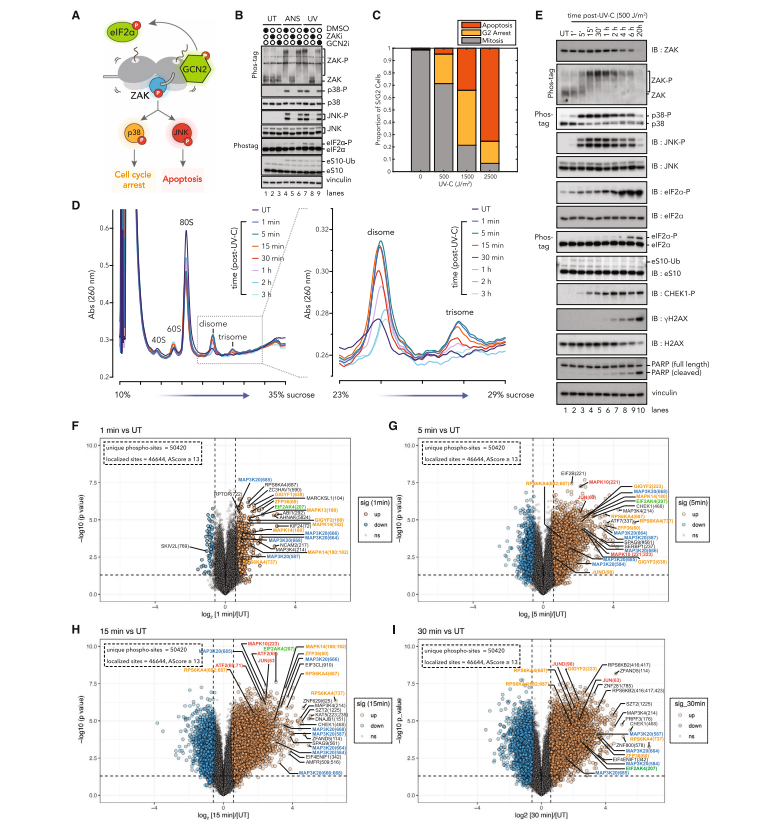
图3.
对紫外线辐射的即时早期反应主要是由核糖体介导的信号传导
二、
ZAK和GCN2决定了早期磷酸化蛋白组

研究人员研究了 ZAK 和 GCN2 对紫外线处理后磷酸化蛋白质组重塑的贡献。
通过在ZAK基因敲除(ΔZAK)和野生型(WT)MCF10a细胞中进行磷酸化和总蛋白组学分析,鉴定了大量依赖于ZAK的磷酸化事件,这些磷酸位点表现出很强的相关性。这些发现揭示了ZAK在UV诱导的RSR中的中心作用,并且ZAK介导的信号传导驱动了UV下游的大多数即时早期RSR响应。
通过GCN2敲除(ΔGCN2)和WT MCF10a细胞中的磷酸化和总蛋白质组学分析,鉴定UV处理后的GCN2底物。GCN2的缺失导致eIF2a激酶的磷酸化水平降低,这表明GCN2在UV应激下对eIF2a激酶活性至关重要。
GCN2的活性还与mTOR活性的调节有关,mTOR是一种蛋白质激酶,它在细胞内扮演着关键的调节角色,控制着许多生物学过程,包括细胞的生长、蛋白质的合成、细胞代谢以及对营养和能量状态的响应。mTOR是mTOR信号通路的核心组成部分,该通路在细胞应激反应和细胞周期控制中起着至关重要的作用。GCN2的缺失导致mTOR活性增加,这可能与细胞对UV应激反应的增强有关。(图4)
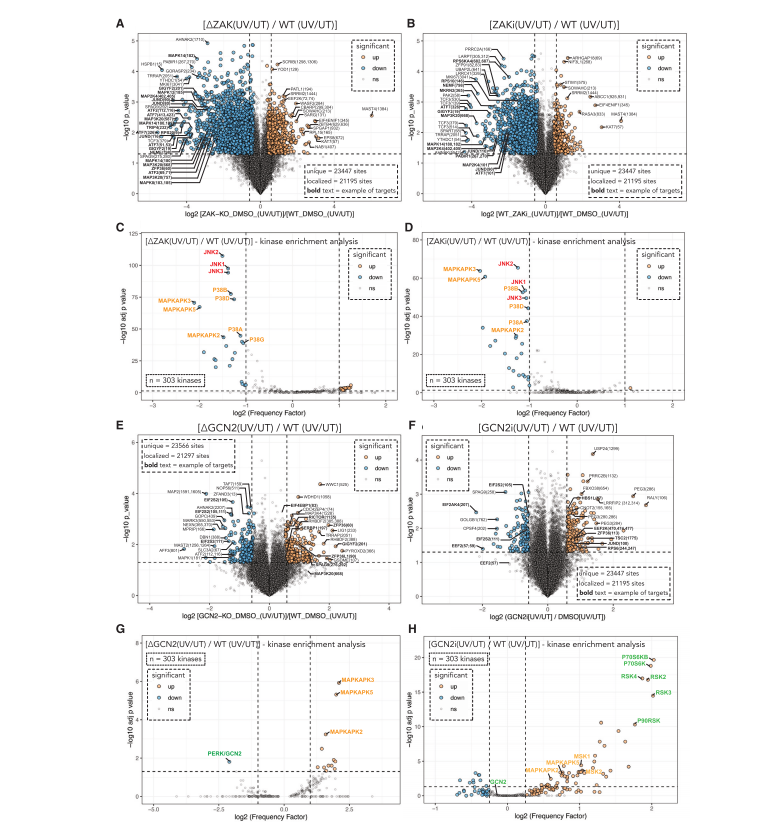
图4.
ZAK和GCN2活性决定了细胞对紫外线介导的核毒性应激反应的早期磷酸蛋白组
三、
ZAK 途径介导UV细胞凋亡

使用生化和免疫荧光实验,研究人员发现ZAK抑制阻止了UV诱导的p38和JNK的磷酸化,而不影响CHEK1的磷酸化。此外,使用ZAK或DDR抑制剂预处理的细胞在UV辐射后的细胞死亡测量结果表明,ZAK抑制完全逆转了细胞凋亡,而针对CHEK1、ATR或ATR和ATM的抑制剂则没有这种效果,说明ZAK通过RSR驱动早期细胞凋亡,以响应UV。(图5)
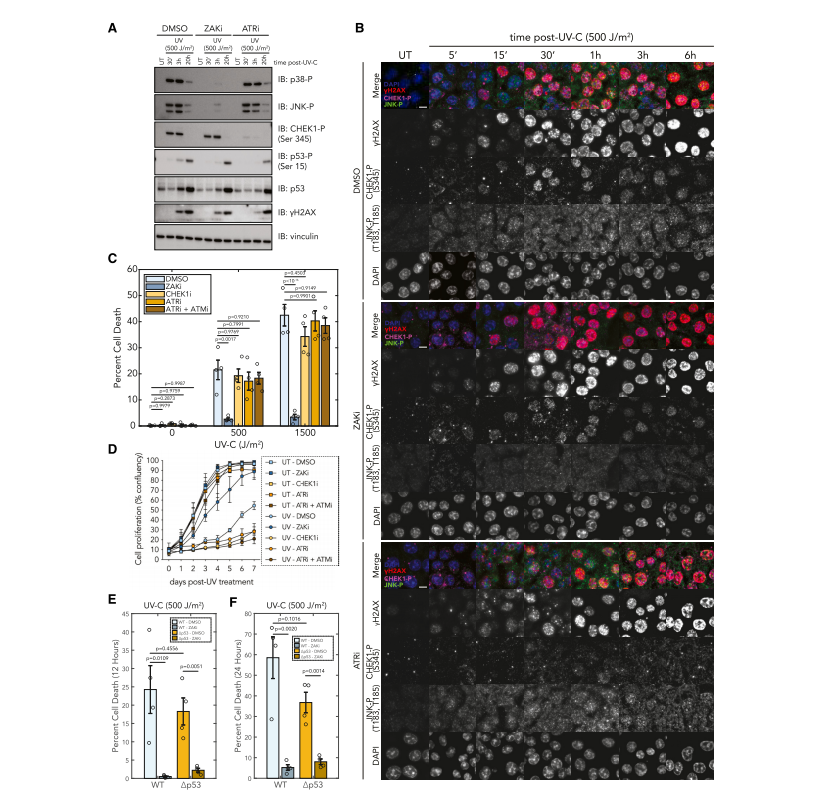
图5.
紫外线导致的细胞凋亡反应是通过ZAK而非DDR途径介导的
四、
GCN2防止ZAK介导的细胞凋亡

在GCN2基因敲除的细胞中,UV辐射后核糖体碰撞的积累导致ZAK活性的持续增加,从而增强了JNK信号的激活。活细胞成像显示,这种增加的JNK活性与GCN2缺失细胞中增加的细胞凋亡有关。这些结果支持了一个模型,其中 GCN2 激活限制了碰撞核糖体在受损 mRNA 上的积累,并通过减弱 ZAK 介导的 JNK 信号转导来限制细胞凋亡。(图6)
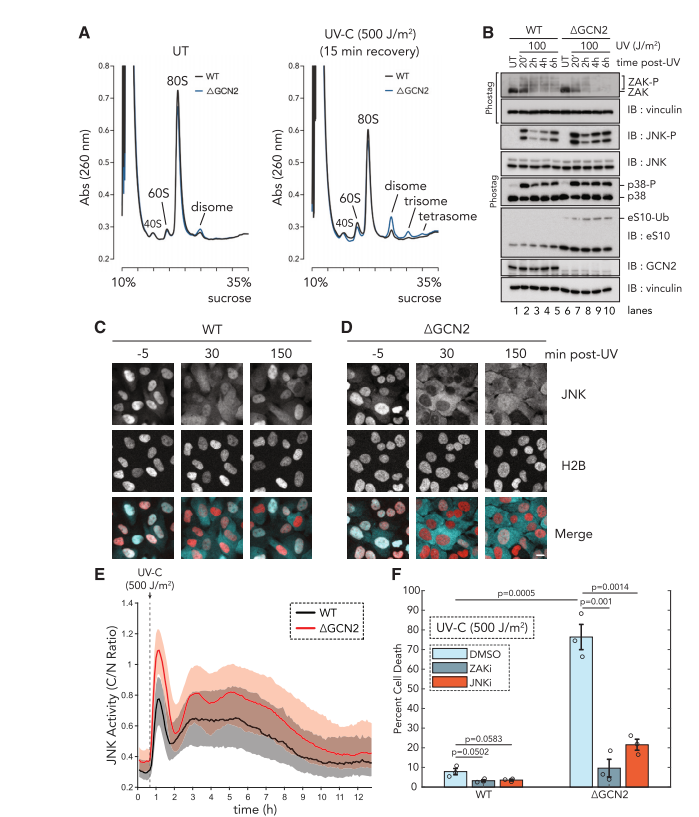
图6.
GCN2通过限制核糖体积累阻止ZAK介导的细胞死亡
五、
ZAK自磷酸化调节及其降解

ZAK的某些磷酸化位点在UV辐射后迅速变化,并与β-TrCP识别的磷酸降解子序列相匹配,导致ZAK通过CUL1-RBX1-SKP1(CRL1)泛素连接酶复合体的降解。β-TrCP是CRL1泛素连接酶复合体的底物适配器,负责促进特定磷酸化底物的蛋白酶体降解。这种自我磷酸化事件在信号终止中起着关键作用,ZAK的降解限制了JNK的持续激活,从而防止了过度的细胞凋亡,并可能促进了细胞对持续应激的耐受性。(图7)
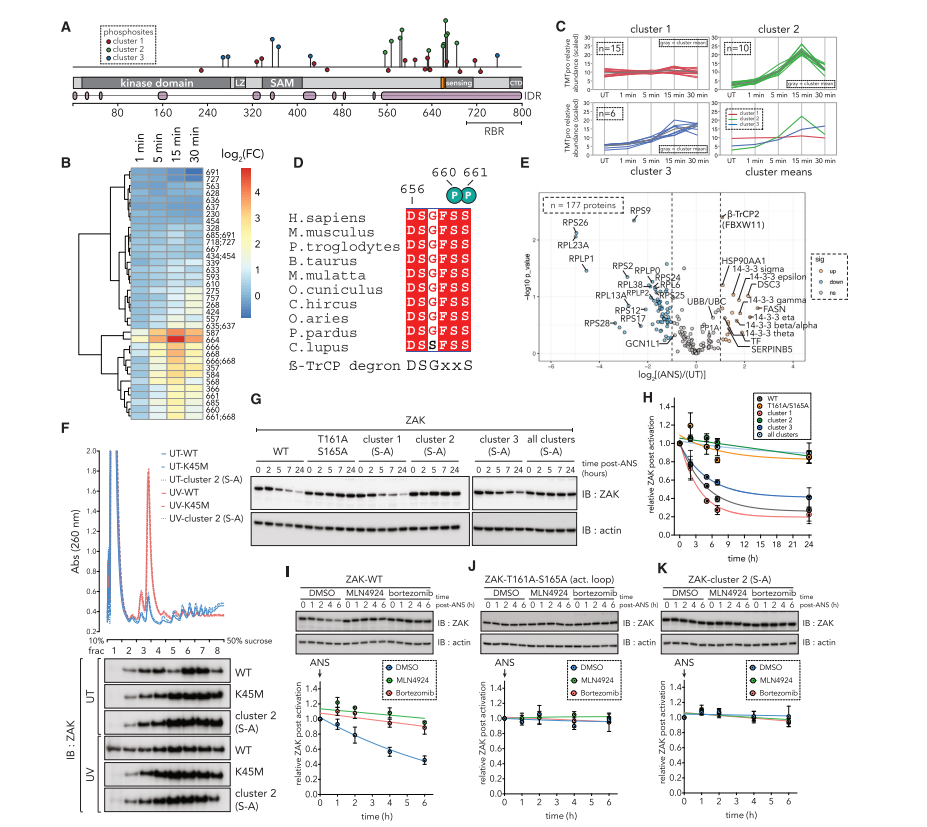
图7.
ZAK自磷酸化调节核糖体解离和随后的降解
通过使用不同的ZAK变体,包括野生型、激酶失活型和特定磷酸化位点突变型,研究人员观察了这些变体在UV辐射或核糖体碰撞诱导的应激条件下对细胞凋亡和耐受性的影响。实验结果支持了ZAK降解在调节细胞凋亡和耐受性中的关键作用。
ZAK降解的长期影响也在细胞增殖实验中进行了评估。观察经ANS预处理后,ZAK野生型和磷酸化位点突变型细胞在随后的UV辐射下的增殖能力。结果表明,ZAK的降解对于细胞在持续应激条件下的长期存活和增殖同样重要。(图8)
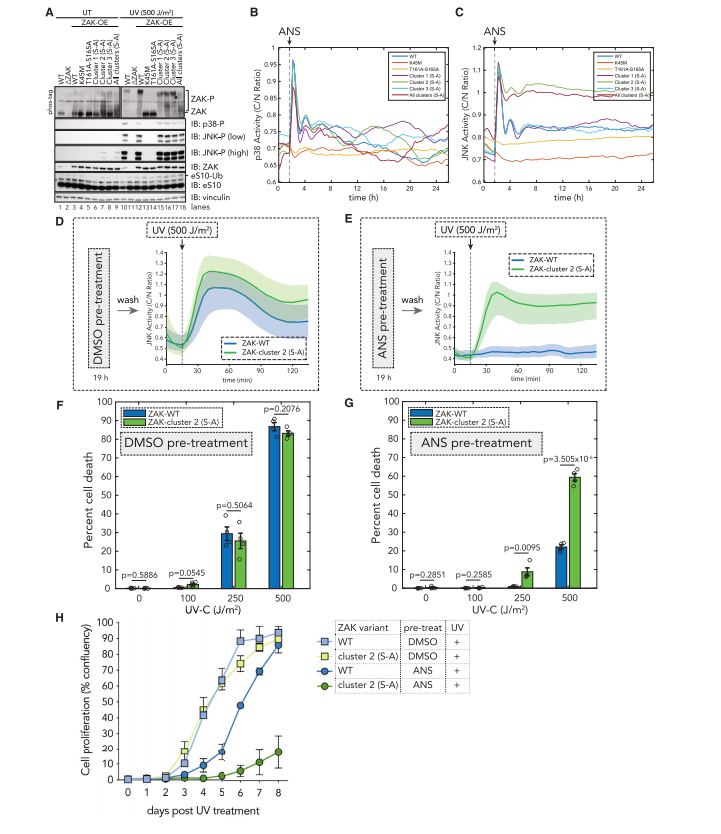
图8.
在持续的核糖毒性应激条件下,ZAK降解限制细胞凋亡并诱导耐受性
以上揭示了ZAK作为细胞应激响应中的一个关键调控节点,通过其自我磷酸化和降解过程,影响细胞的生存和死亡决策。
DISCUSSION
•
✦
研究讨论
✦
•
研究局限性
1 | GCN2与mTOR活性调节的机制不明确: 尽管研究指出GCN2通过磷酸化eIF2α来抑制mTOR活性,但具体的机制,尤其是在UV辐射后的快速响应中,尚不清楚。 |
2 | 不同细胞类型的影响: 不同细胞类型可能因ZAK表达水平、降解速率和蛋白合成负载的差异而具有不同的凋亡触发阈值,这需要在未来的研究中进行更详细的探讨。 |
3 | RSR诱导的凋亡在临床治疗中的潜在影响: 研究提到的RSR诱导凋亡可能对避免UV暴露后的癌变至关重要,但如何在临床上利用这一机制来提高治疗效果或减少不良反应,需要进一步的研究。 |
小结
Summary

本研究揭示了紫外线诱导的核糖体碰撞中调控ZAK活性的分子机制。ZAK触发细胞即时早期反应,重新配置全局磷酸化蛋白组。通过 ZAK 的 RSR 信号转导,而不是 DDR 信号转导,负责响应 UV 的早期细胞凋亡和细胞周期停滞。
两种负反馈机制调节紫外线照射后的RSR:①GCN2激活通过减少对受损mRNA的碰撞来限制ZAK的活性;②ZAK中一个保守磷酸化的自磷酸化促进其降解。缺乏以上任何一种机制都会增加紫外线照射细胞的凋亡。
参考文献
[1] Sinha, Niladri K., McKenney, Connor., Yeow, Zhong Y., Li, Jeffrey J., & Nam, Ki Hong.. (2024). The ribotoxic stress response drives UV-mediated cell death. Cell.
PROFILE
Rachel Green
约翰霍普金斯大学医学院教授兼主任
The Green Lab的工作重点是了解核糖体如何在分子水平上发挥作用,以及其活性的变化如何导致mRNA质量控制和细胞应激反应的诱导。正在进行的大部分工作都集中在核糖体碰撞在激活信号通路(如综合应激反应 (ISR) 和各种 MAP 激酶级联反应)中的重要性。
END
文案 | 姜笑南
排版 | 姜笑南
审核 | 姜笑南
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
