
血管生成素是一种RNase-A家族蛋白,促进血管生成,并与癌症、神经退行性疾病和表观遗传有关。在细胞应激激活时,血管生成素在反密码子环上切割tRNA,产生缺口tRNA并导致翻译和其他下游效应的有效抑制。然而,通过分离得到的血管生成素的催化活性很低,酶的激活和tRNA特异性机制仍然是一个谜。
近日,马萨诸塞大学Anna B.Loveland等人在顶刊《Nature》上发表了一篇研究论文,名为《Structural mechanism of angiogenin activation by the ribosome》。研究人员使用生化分析和低温电子显微镜揭示了血管生成素的激活机制。(图1)

研究表明,细胞质核糖体是一直以来都在寻求的血管生成素激活剂。2.8-Å分辨率的低温电镜结构显示血管生成素结合在80S核糖体的A位点。血管生成素的C端尾部通过与核糖体的相互作用重新排列以激活RNase催化中心,使酶在tRNA切割中的效率提高了几个数量级。此外,80S•血管生成素的结构体现了tRNA底物是如何被血管生成素活性位点旁边的核糖体引导的,表明核糖体是特异性因子。研究结果表明,血管生成素被具有空A位点的核糖体激活,其丰度在细胞应激时增加。
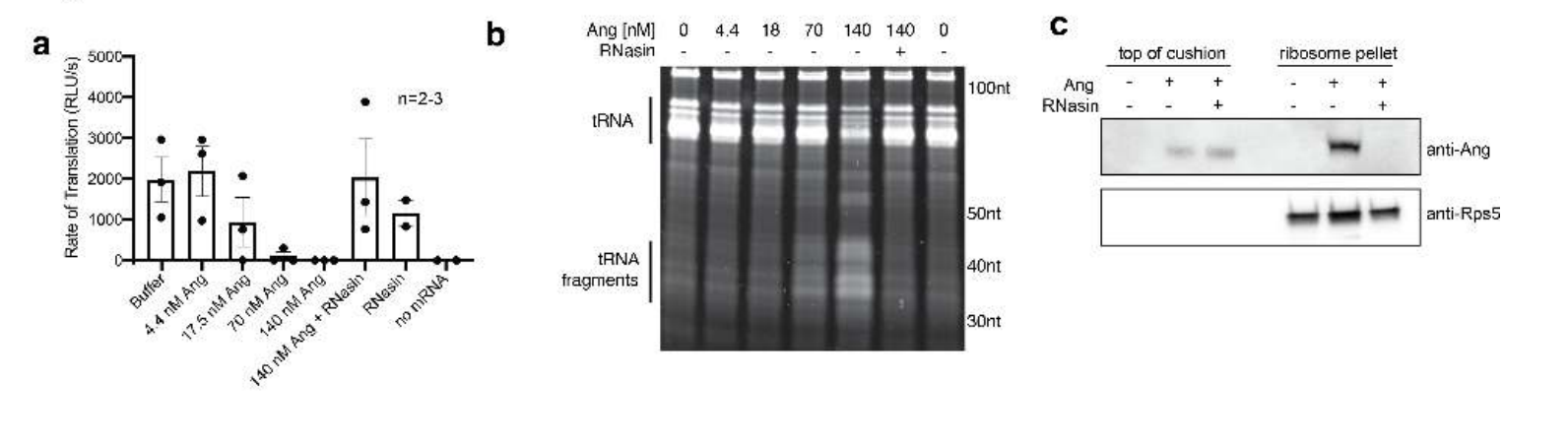
研究人员首先测试了血管生成素对哺乳动物翻译系统的影响。70-140 nM人血管生成素抑制了rabbit reticulocyte lysate(RRL)在不同制剂中的翻译,同时在RRL中会出现与tRNA切割一致的30-40 nt RNA片段。
当用RNasin抑制了血管生成素以后,可以恢复翻译并阻止tRNA片段的积累,表明RNasin可能阻断血管生成素与其激活分子或底物的相互作用。蔗糖缓冲层超离心显示血管生成素存在于核糖体部分。RNasin的加入阻止核糖体结合,表明血管生成素的功能可能取决于它与核糖体的相互作用。(图2)
随后探索血管生成素与核糖体的相互作用,将血管生成素添加到80S•mRNA•tRNA核糖体中,并使用冷冻电镜进行结构分析。3.0-Å分辨率的冷冻电镜图显示了一个分辨率很高的血管生成素结合在核糖体小亚基(40S)的A位点上。血管生成素的溶剂可及表面积与核糖体相互作用,表现出强烈且特异性的结合。血管生成素通过极性和疏水性基团与解码中心的所有元件相互作用,包括28S rRNA、18S rRNA、mRNA和相邻的P-tRNA。
血管生成素中的一些特有残基与28S rRNA的中心螺旋69 (H69)结合,这体现了它们在核糖体结合中的作用。(图3)
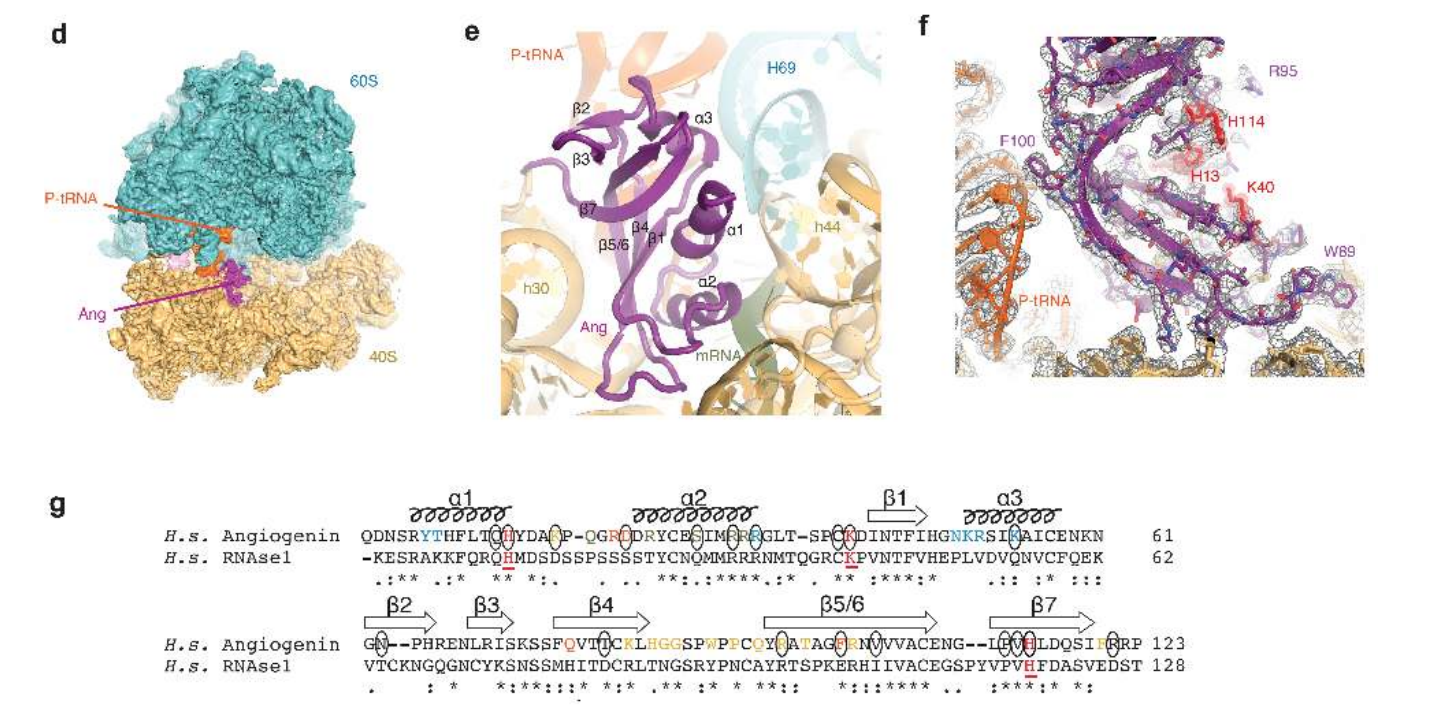
与核糖体解码中心、mRNA和p位点tRNA的广泛相互作用表明,血管生成素与核糖体特异性结合导致核糖体停滞或细胞应激而出现核糖体A位点空缺。血管生成素的核糖体结合活性可能解释了以前无法用血管生成素的细胞受体结合、核定位或其他过程解释的功能丧失或突变。
核糖体结合改变了血管生成素的构象,这表明了该酶催化活化的机制。游离血管生成素的活性比RNase-A低几个数量级,这与血管生成素C端尾部的抑制α-螺旋构象有关。在80S•血管生成素核糖体复合体中,血管生成素的C端移位并重新排列以延长β-7,类似于自由RNase-A。在这种构象中,C端通过与18S rRNA螺旋30 (h30)的小凹槽和邻近的β链5和6的相互作用而稳定,被重组成一个更长的支架,可以称之为β5/6。(图4)

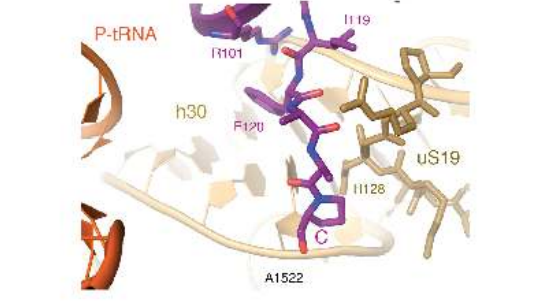
这样,血管生成素的Phe120聚集在h30的A1522和β5/6的Arg101之间,停靠在C1237的磷酸基上,而邻近的Ile119结合在uS19的C端附近。(图5)
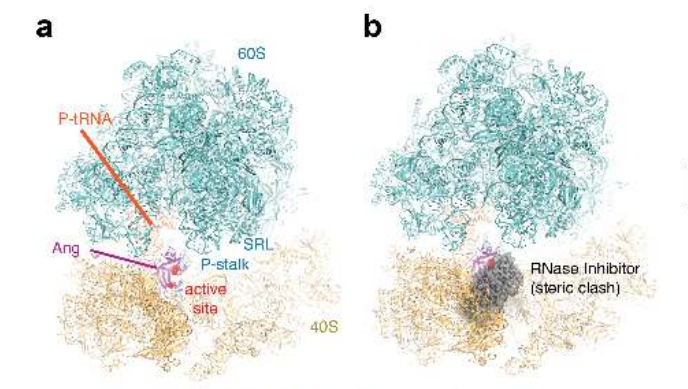
在这种重新排列的血管生成素构象中,催化残基His13和His114的位置与RNase A一样催化底物裂解。活性位点暴露在亚基间的空间,使tRNA底物可以完全进入。(图6)
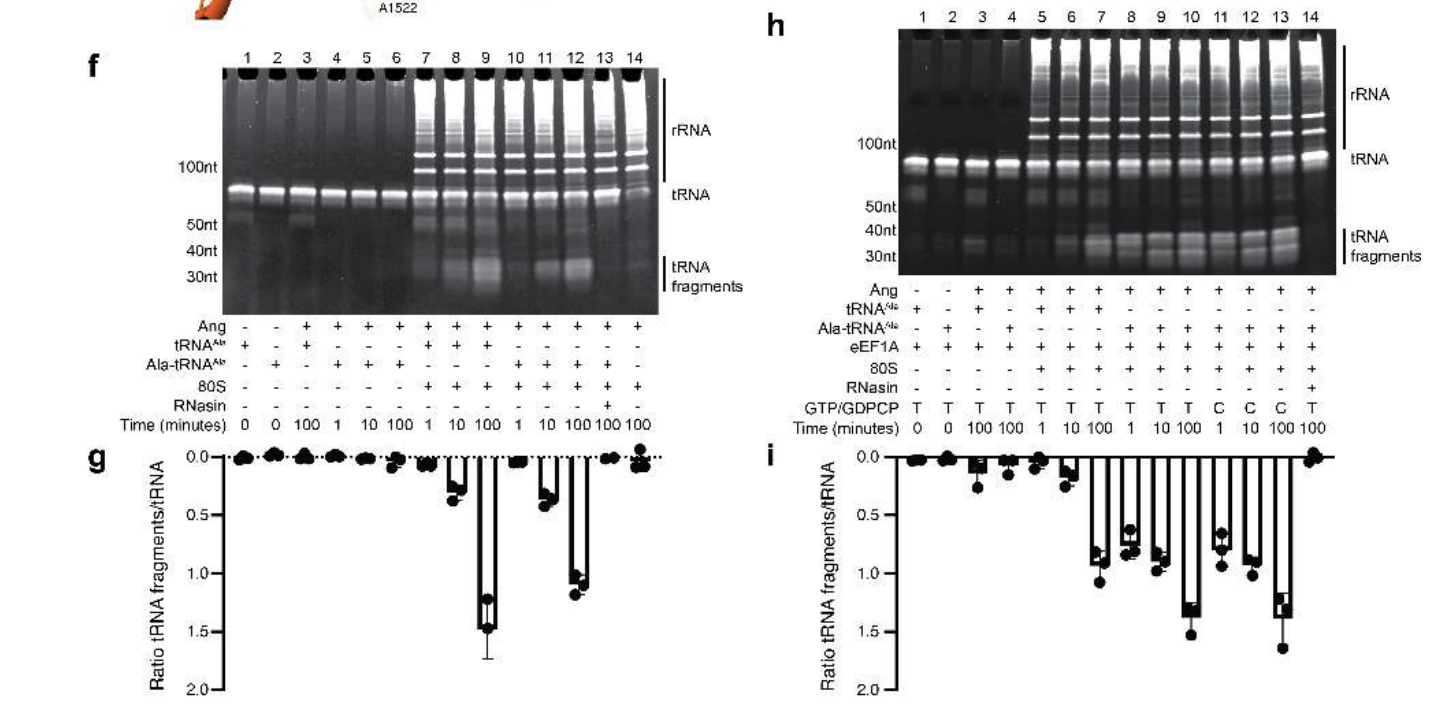
研究人员通过比较血管生成素单独或与细长状80S核糖体复合切割纯化tRNAAla的能力,来确认核糖体是否直接激活血管生成素的RNase活性。tRNAAla是一种已知的血管生成素底物,可产生抑制性tRNA片段。(图7)
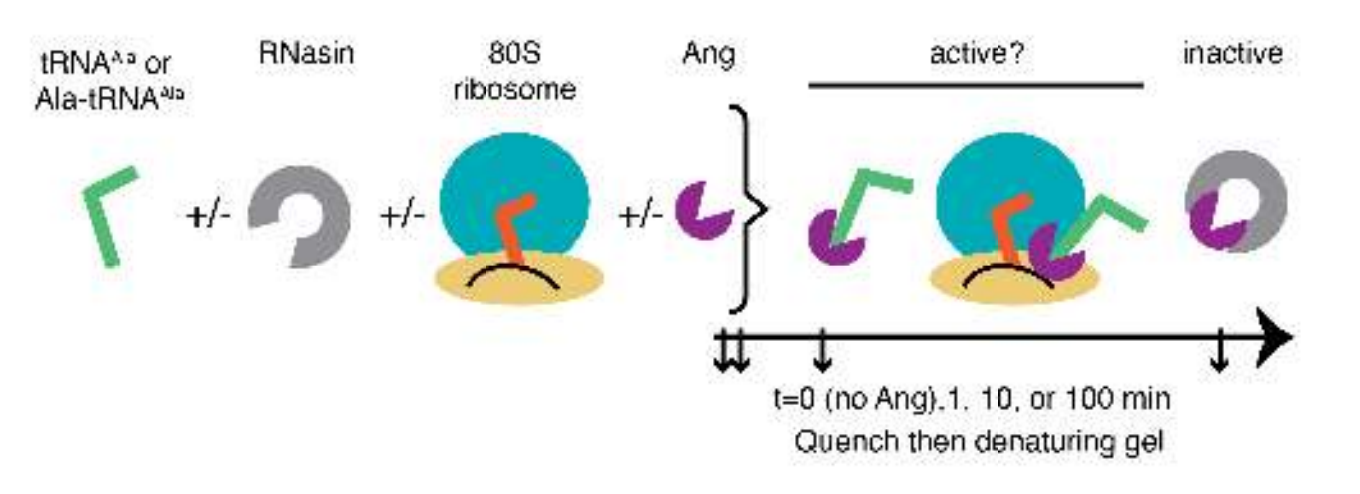
在仅血管生成素存在的情况下,在100分钟内几乎没有检测到tRNAAla的切割。相反,在含有血管生成素和80S核糖体复合物的反应中,加入tRNAAla后1分钟内,~35-nt tRNA片段开始积累,100分钟后,可以检测到超过100倍的切割产物积累。而RNasin在80S复合物存在下阻止tRNA切割,这与RNasin阻断血管生成素与核糖体结合的能力一致。
接下来,研究了翻译延伸因子eEF1A是否可能将tRNA呈递给80S•血管生成素复合体进行切割。翻译延伸因子eEF1A在细胞翻译延伸过程中向核糖体递送氨基酰基tRNA。tRNA切割实验显示,eEF1A进一步刺激核糖体结合血管生成素对氨酰化tRNAAla的tRNA切割,导致tRNA片段在1分钟内的积累比没有eEF1A时高10- 100倍。在GTP或不可水解的GTP类似物GDPCP的存在下,eEF1A同样刺激了氨基酰化tRNA的裂解。这些结果表明,eEF1A结合核糖体可以使tRNA在血管生成素催化位点上有最佳呈现,但tRNA的切割并不需要eEF1A水解GTP。(图8)
研究人员使用冷冻电镜(cryo-EM)分析了80S•血管生成素复合物和eEF1A•Ala-tRNAAla•GDPCP三元复合物,以了解tRNA是如何被核糖体结合的血管生成素传递和定位并进行切割的。
cryo-EM数据集的最大似然分类揭示了三种与血管生成素结合的核糖体复合物。80S•血管生成素;80S•血管生成素与eEF1A和Ala-tRNAAla;80S•血管生成素与tRNAAla。(图9)
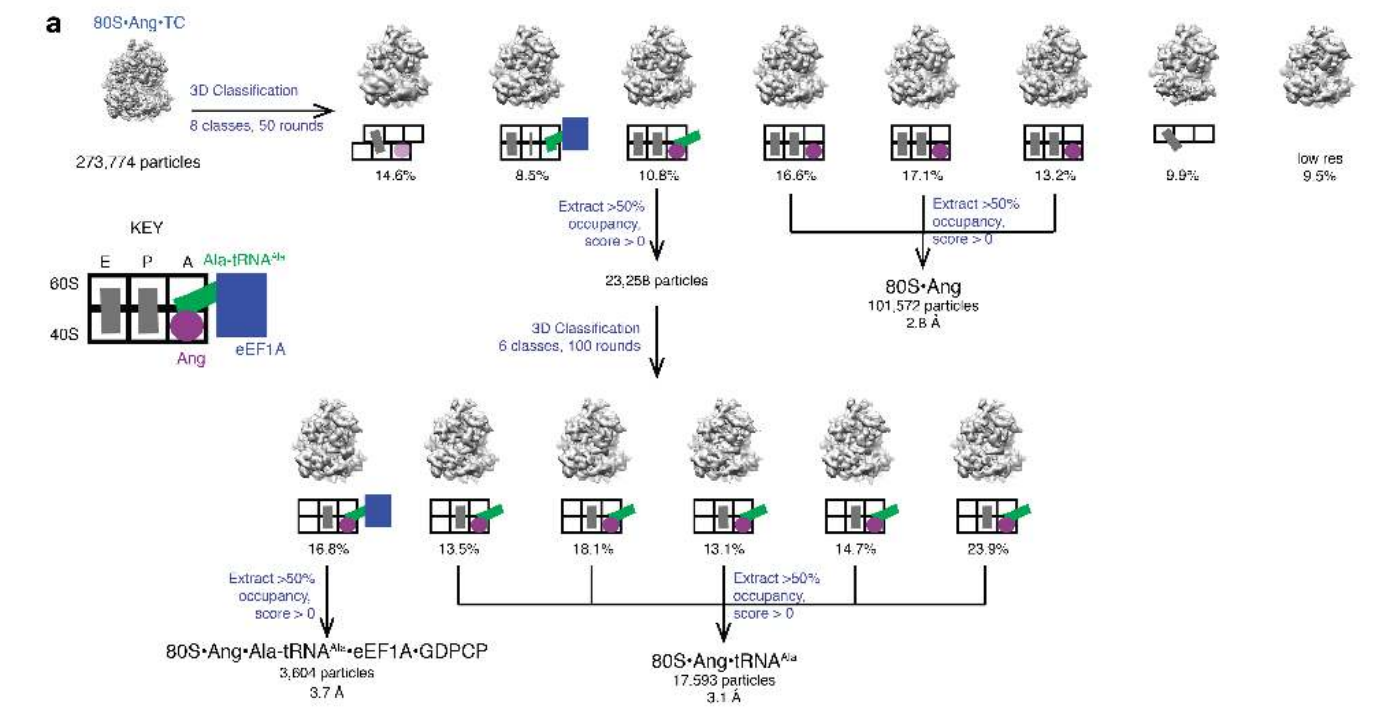
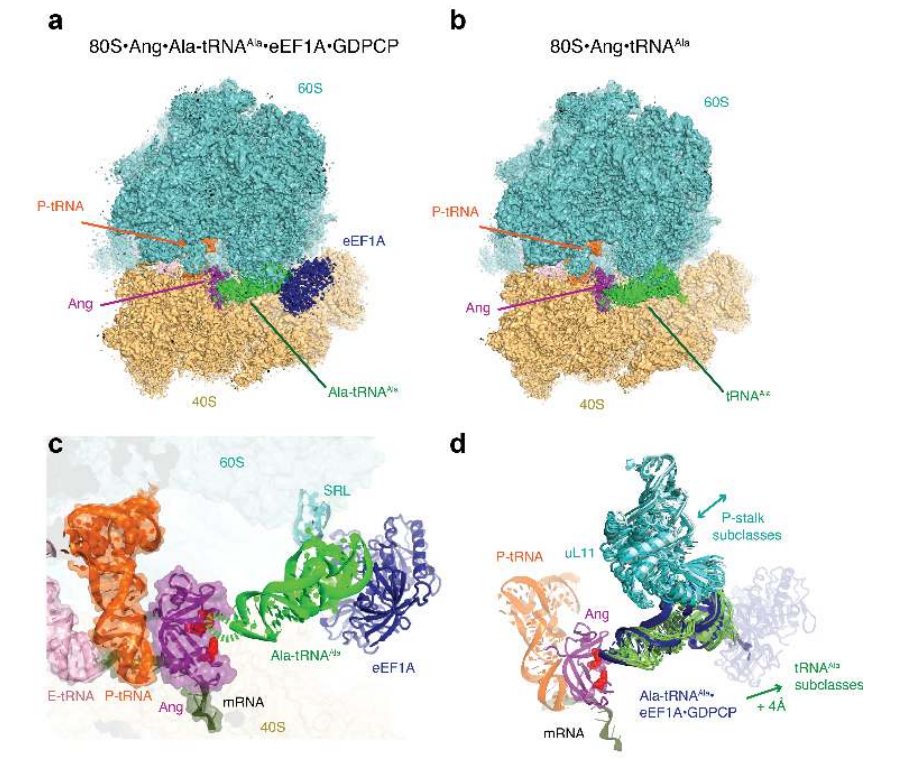
在eEF1A和Ala-tRNAAla的结构中,反密码子茎(U38)的最后一个模拟tRNA核苷酸的磷酸被放置在血管生成素活性位点附近,与该位置附近的催化裂解一致。与血管生成素相比,tRNAAla的cryo-EM密度分辨率较低,但tRNA的典型L形结构清晰可见,这表明切割不会破坏tRNA的整体折叠。两个主要的接触将缺口tRNA固定在适当的位置:肘部与动态P柄的28S rRNA相互作用,类似于mRNA解码过程中观察到的相互作用;tRNA的受体臂与eEF1A结合,eEF1A停泊在距离大亚基sarcine -ricin loop (SRL)约10 Å的40S核糖体亚基上。eEF1A在远离SRL(mRNA解码复合体中GTP酶激活的位点)的位置,即证明核糖体结合的血管生成素切割tRNA不需要GTP水解。
与eEF1A结合的tRNA(深蓝色)相比,去酰基tRNA(绿色)向外移位超过4 Å。在80S•血管生成素•tRNAAla结构中,断裂tRNA的位置与eEF1A的位置略有不同。当tRNA的反密码子茎靠近血管生成素时,肘部被P柄进一步伸出。低温电镜(cryo-EM)密度的亚分类表明,P柄和tRNA的几个位置在受体臂的尖端相差高达8 Å。P柄对tRNA的灵活束缚可能允许反密码子环内的不同核苷酸进入血管生成素的活性位点,从而导致各种或所有tRNA物种的切割。3 ' -CCA端靠近或停靠在残基A50附近的18S rRNA螺旋5 (h5)处。这种相互作用与eEF1A的结合在空间上是不相容的,这表明这种结构可能是一种脱酰基tRNA,最初与核糖体结合时没有eEF1A。因此,带有缺口tRNAAla的冷冻电镜结构显示了核糖体结合的血管生成素如何切割tRNA,无论它们是否由eEF1A递送,这与上面的生化观察结果一致。(图10)
毋庸置疑,要想阐明血管生成素的功能和治疗潜力,就需要了解其激活的机制。这项研究表明,血管生成素是由一个空的A位点核糖体激活的,在细胞应激过程中,A位点表现出积累效应。核糖体结合重新排列血管生成素的活性位点,将催化作用的残基导向进入tRNA底物。这种结构机制不仅解释了血管生成素的激活,还解释了核糖体提供的底物特异性,其P柄被调整为tRNA递送。
另外,血管生成素介导的tRNA切割,可以通过消耗功能性tRNA或通过与tRNA相互作用的分子(如核糖体和tRNA结合酶)产生非生产的tRNA样切割产物的停滞复合物,来抑制翻译。
研究人员表示,未来的工作将研究tRNA样裂解产物的下游作用,并探索靶向核糖体驱动的血管生成素激活的治疗途径。
DOI:https://doi.org/10.1038/s41586-024-07508-8