

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
帕金森病以中脑黑质多巴胺神经元的特异性缺失为主要病理特征,导致了帕金森病患者运动功能障碍,但是目前临床的治疗方式均无法延缓或者阻止多巴胺能神经元的死亡,这使得细胞替代成为一种有前景的治疗方法。但目前由于免疫排斥等原因导致移植的多巴胺神经存活率低是细胞治疗走向临床的主要障碍之一。
2023年7月12日,美国麻省总医院(Massachusetts General Hospital)神经外科和麦克莱恩医院(McLean Hospital)分子神经生物学实验室Kwang-Soo Kim及其研究团队在 Nature 期刊发表了题为:Co-transplantation of autologous Treg cells in a cell therapy for Parkinson’s disease 的研究论文。
研究意义
Significance
该研究发现了细胞移植的手术操作会触发脑内的急性神经炎症、外周免疫细胞的强烈浸润和脑细胞死亡。目前已有的研究表明将人诱导多能干细胞来源的中脑多巴胺细胞移植到啮齿类动物纹状体,移植后2周,植入的酪氨酸羟化酶阳性细胞即多巴胺能神经元的存活率不足10%,严重影响细胞移植的治疗效果。
该研究创新性的发现自体调节性T细胞与多巴胺能神经元共同移植极大地改变了手术带来的免疫反应,抑制了急性神经炎症和免疫细胞浸润。同时与T细胞共移植也抑制了多巴胺能神经元移植物的不良增殖,多巴胺能神经元的比例和绝对数量更高。
总之,本研究强调了细胞治疗手术损伤的初始炎症反应在多巴胺能神经元移植后存活的重要性,并提示联合移植自体T细胞有效地减少了手术移植创伤导致的细胞死亡,为帕金森病的细胞治疗提供了一种潜在的策略,以获得更好的临床结果。
METHODS
•
✦
研究方法
✦
•
这项研究主要采用了体细胞重编程技术,这是一种革命性的生物学技术,它可以重新编程成熟的体细胞,使其回到一种类似于胚胎干细胞的状态,这种状态被称为诱导多能性。这项技术的开发者之一是日本科学家山中伸弥,他在2006年首次成功将成熟的体细胞转变为诱导多能性干细胞(iPSCs),这一发现获得了2012年诺贝尔生理学或医学奖。
技术原理
Principles
体细胞重编程技术的原理是通过引入一组特定的基因或一些化学物质,重新激活细胞中的干细胞相关基因,使细胞的表观遗传状态重新配置,从而实现细胞的去分化和再分化。这使得成熟的体细胞可以转变为能够分化为各种细胞类型的多能性干细胞,包括心脏细胞、神经细胞、肝细胞等。
应用潜力
Potentials
体细胞重编程技术具有巨大的临床潜力。
首先,它为疾病建模和药物筛选提供了全新的平台。通过从患者提取细胞,将其转变为多能性干细胞,然后分化成患者特定的细胞类型,科学家可以模拟疾病的发生和发展过程,从而更好地理解疾病的机制,寻找新的治疗方法。
其次,体细胞重编程技术还为再生医学提供了新的途径。例如,可以利用诱导多能性干细胞重新生成受损的组织或器官,如心脏、肝脏、胰岛等,为治疗心脏病、肝病、糖尿病等疾病提供了新的可能性。
此外,由于诱导多能性干细胞可以从患者自身获得,因此避免了免疫排斥反应的问题,具有更好的生物相容性和安全性。
应用挑战
Challenges
总的来说,体细胞重编程技术的发展为医学领域带来了巨大的希望,有望成为未来治疗各种疾病的重要工具。然而,尽管取得了显著进展,但这项技术仍面临着许多挑战,如细胞质量控制、肿瘤形成风险等,需要进一步的研究和改进。
FINDINGS
•
✦
研究发现
✦
•
数据1
细胞移植针刺诱导的神经炎症对移植细胞的影响
为了模拟人类mDANs在自体环境中的早期存活率,本研究将PD患者C4来源的iPS细胞衍生的中脑多巴胺祖细胞(mDAPs)移植到小鼠的纹状体中,小鼠在移植后两周通过免疫组织化学检查纹状体内的移植物中多巴胺能神经元的存活率。数据显示,移植物中的mDAN在早期阶段陆续死亡,即使在免疫缺陷的小鼠中,移植物的死亡率也极高。与此同时,该研究关注到移植多巴胺能神经元移植物中促炎细胞因子分泌显著增高,同时促炎细胞因子诱导的多巴胺能神经元移植物细胞死亡,提示干预神经炎症有望提高移植物中多巴胺能神经元的状态。
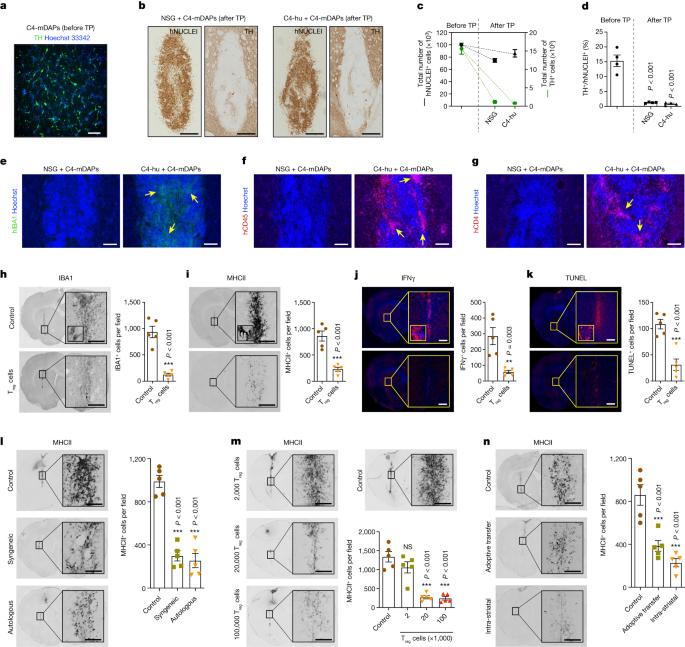
数据2
调节性T细胞与C4-MDAP联合移植的作用
根据上述数据,该研究团队认为免疫宿主自体Treg细胞的线内共移植将保护移植的mDANs在细胞治疗期间由于针头创伤诱导的细胞死亡。并通过实验进行论证,首先利用大鼠PD模型,将C4-mDAPs和自体大鼠Treg细胞移植到每只6-OHDA诱导的PD大鼠的纹状体中,并在移植后每月监测安非他明诱导的旋转行为。研究发现与自体Treg细胞联合移植显著改善了6-OHDA导致的PD行为学障碍。病理学检测发现Treg细胞联合移植可以显著增加移植物内多巴胺能神经元的存活率。
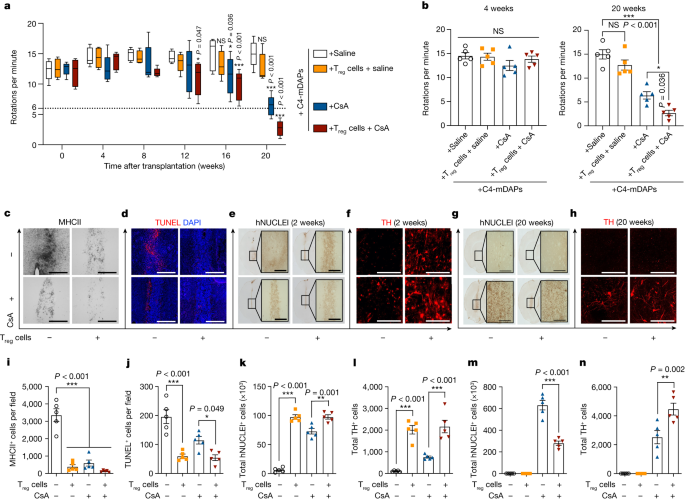
数据3
Treg与多巴胺能神经元共移植的体内效应
进一步,该研究使用同一患者的mDAP和Treg细胞(C4-Treg细胞)在自体环境中检查了Treg细胞的治疗效果。为此,首先通过将6-OHDA立体注射到黑质中,并将C4-mDAPs和C4-Treg细胞共同移植到纹状体中,在移植后两个月调查了C4-Treg联合移植的效果。对移植物的组织进行进一步分析表明,与Treg细胞共同移植的小鼠相比,Treg联合移植组的多巴胺能神经元的细胞数量更高。因此,尽管本研究无法测试自体Treg联合移植的长期益处,其结果支持联合移植自体Treg细胞保护mDAN免受针头创伤的急性宿主炎症反应,并提高其生存率的观点。
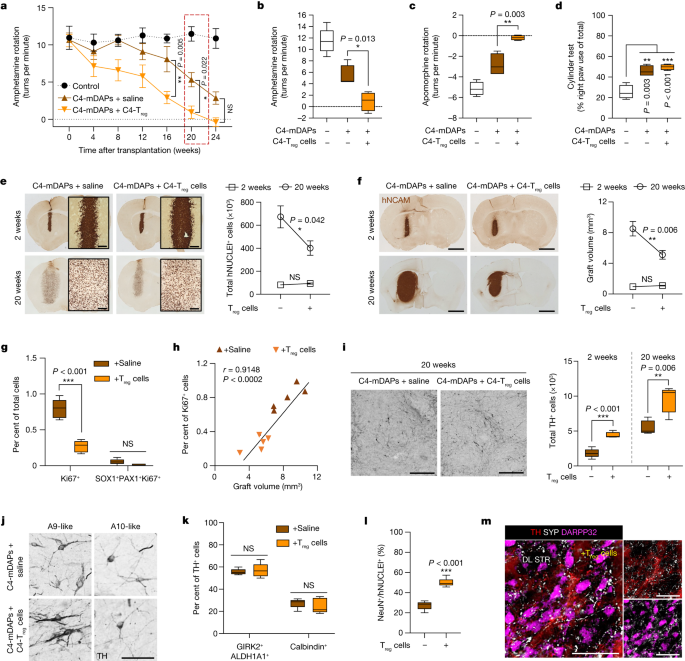
参考文献
[1] Park, TY., Jeon, J., Lee, N. et al. Co-transplantation of autologous Treg cells in a cell therapy for Parkinson’s disease. Nature 619, 606–615 (2023). https://doi.org/10.1038/s41586-023-06300-4
PROFILE
Kwang-Soo Kim
哈佛医学院精神病学和神经科学教授、麦克莱恩医院分子神经生物学实验室主任
帕金森病、多动症和精神分裂症等主要脑部疾病与细胞异常密切相关,Kim博士及其团队专注于鉴定这些细胞异常的组成部分,例如Nurr1,它被认为是与人类相关疾病相关的潜在药物靶点。目前,该实验室正在寻找针对 Nurr1 靶点的候选药物,以期望能够减缓帕金森病的进展。此外,Kim博士的实验室领先采用一种新技术,开发出安全且患者特异性的干细胞。这一突破对于治疗和研究人类疾病具有巨大潜力。细胞替代疗法需要临床安全的干细胞,这些干细胞能够产生许多甚至所有类型的细胞。大多数干细胞是通过病毒载体获得的,因此不适合用于研究和潜在治疗人类疾病。该实验室首创直接输送重新编程蛋白质的方法,生成安全的人类干细胞。与此同时Kim博士的实验室通过代谢控制确定了重新编程过程背后的新机制,这使得能够设计出更高效、更安全的重新编程方法。采用新方法生成的新的干细胞可能代表生物医学和临床上理想的细胞,为研究人类疾病机制和实现个性化细胞替代疗法的长期目标提供了潜在的平台。
END
文案 | 方秋园
排版 | 夏小倩
审核 | 夏小倩
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展