

Fig.1
INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
共价靶向放射性核素治疗是癌症治疗的一个新兴领域,即放射性药物将强效放射性核素输送到肿瘤并进行局部照射,解决未满足的临床需求,改善癌症患者的预后。目前,治疗的放射性药物在实现可持续的肿瘤靶向并将其快速地从健康组织中清除方面,仍然是一个重大挑战。因此,开发一种有选择性地将放射性药物固定在肿瘤靶蛋白上的靶向结扎策略,将是一种理想的解决方案。(Fig.2)
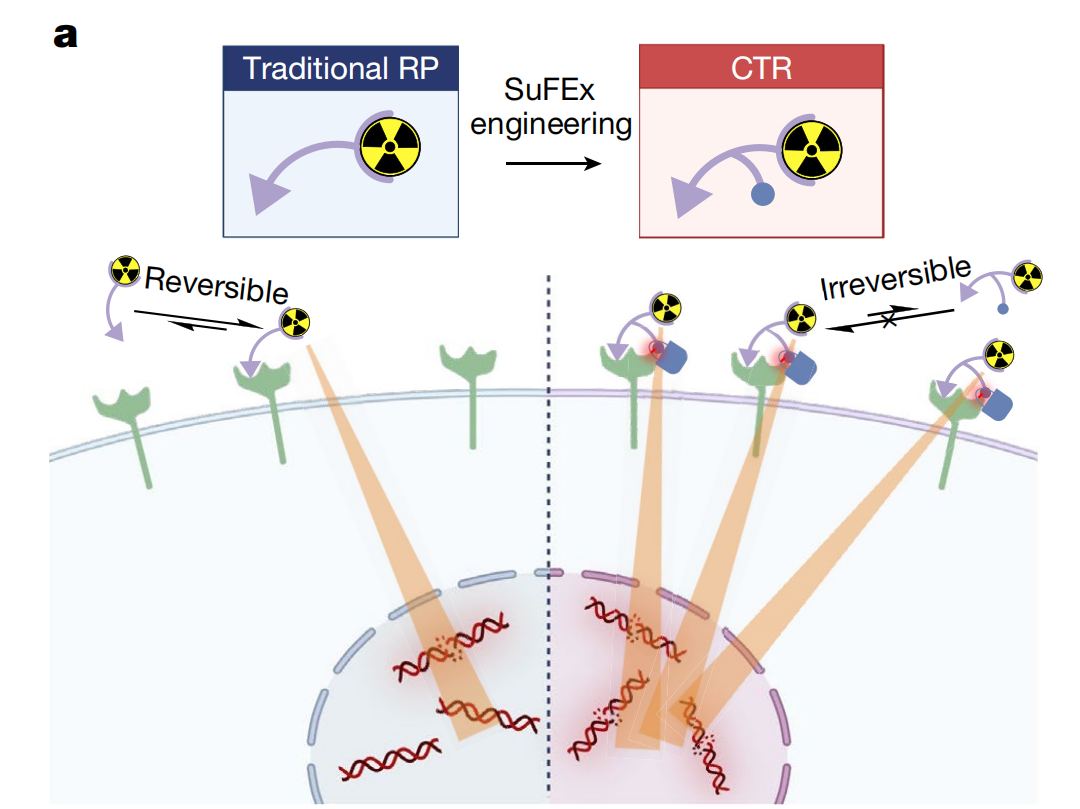
Fig.2
2024年5月22日,北京大学/昌平实验室的刘志博教授团队,在《Nature》上发表了一篇关于核药物设计的文章,这是《Nature》近50年来发布的首篇放射性核素治疗领域的论文。(Fig.1)
研究意义
Significance
研究人员旨在开发一种共价靶向放射性配体(CTR),由此提出了一种通过硫(VI)氟化物交换(SuFEx)化学基团的链接器来增强放射性药物肿瘤靶向性的方法。
这种策略能够选择性地将放射性药物固定在肿瘤特异性蛋白上。当改造过的放射性药物与肿瘤特异性蛋白结合时,会经历一个从结合到连接的转变,并通过“点击”SuFEx反应与蛋白质中的酪氨酸残基实现更容易地共轭。(Fig.3)
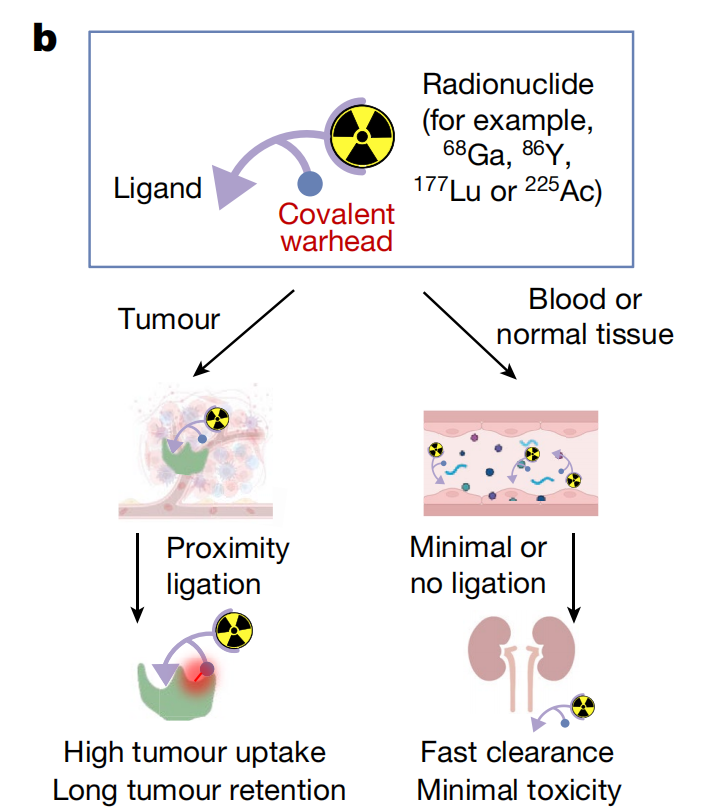
Fig.3
研究结果显示,采用这种方法改造的药物与蛋白质的共价结合率超过80%,且在6天内几乎没有解离。在实验小鼠中,SuFEx改造的药物相比于原始药物,肿瘤吸收率增加了257%,肿瘤保留率提高了13倍。同时,健康组织中的吸收物质能迅速被清除。初步成像研究显示,这种方法能够比其他方法识别出更多癌症患者的肿瘤病灶。
此外,采用SuFEx技术改造的针对纤维母细胞激活蛋白(FAP)抑制剂(FAPI)和针对前列腺特异性膜抗原(PSMA)的放射性配体,均显示出增强的治疗效果。由于SuFEx弹头可以连接到潜在的广泛蛋白质,因此这种策略可能被扩展应用于其他癌症治疗靶点。
METHODS
•
✦
研究方法
✦
•
经典方法
1 | 分子对接和分子动力学模拟:使用分子对接软件GOLD和分子动力学模拟软件AMBER研究FAPI与FAP的结合模式。 |
2 | 放射性标记:使用放射性核素68Ga和177Lu对小分子进行放射性标记,用于PET/CT成像和治疗。 |
3 | 体外结合实验:使用竞争性结合实验和SDS-PAGE分析评价FAPI与FAP的结合。 |
4
细胞摄取和保留实验:使用荧光标记的小分子,评价FAPI在细胞内的摄取和保留。
RESULTS
•
✦
研究结果
✦
•
CTRs增加肿瘤对放射性配体的摄取
01
出于应用广泛性考虑,研究人员选择成纤维细胞激活蛋白(FAP),作为开发CTR的靶标。CTR设计的一般工作流程如图所示。(Fig.4)
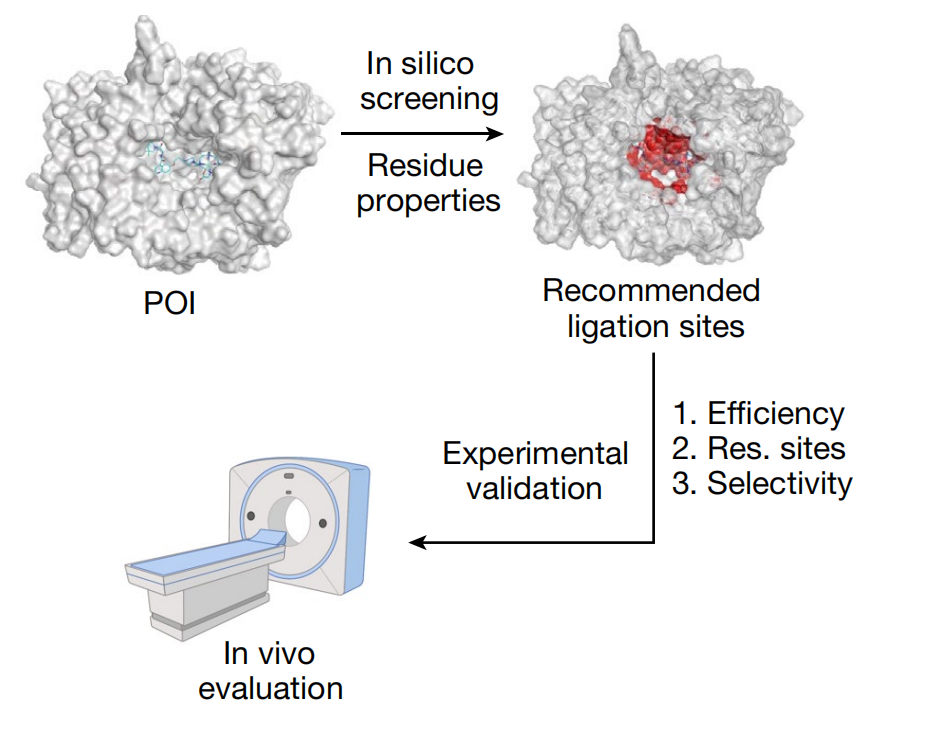
Fig.4
首先使用GOLD软件(一款分子对接程序)确认 FAPI 修饰的起始点。FAP活性位点的微环境,包含高度亲核的Y450和邻近的Y210,由此研究人员的注意力转向了硫(VI)氟交换(SuFEx)潜在弹头,它与多种氨基酸(包括酪氨酸20)表现出反应性。据报道,它们的接近性与反应性赋予了它们在到达目标之前具有高稳定性和生物正交性,这使它们能够用于小分子抑制剂、蛋白质和其他生物分子。
安装SuFEx后,经构效关系预测选定反应性更高的FAPI-SF(1),并对其进行了177lu放射性标记。在体外实验中,与FAP孵育后表现出快速且不可逆的共价结合。在荷瘤小鼠体内正电子发射断层扫描和计算机断层扫描(PET/CT)成像显示,装载SF后的FAPI肿瘤摄取明显大于普通FAPI。且清除迅速,主要通过肾脏系统发生,在其他主要器官的积累几乎可以忽略不计。(Fig.5)
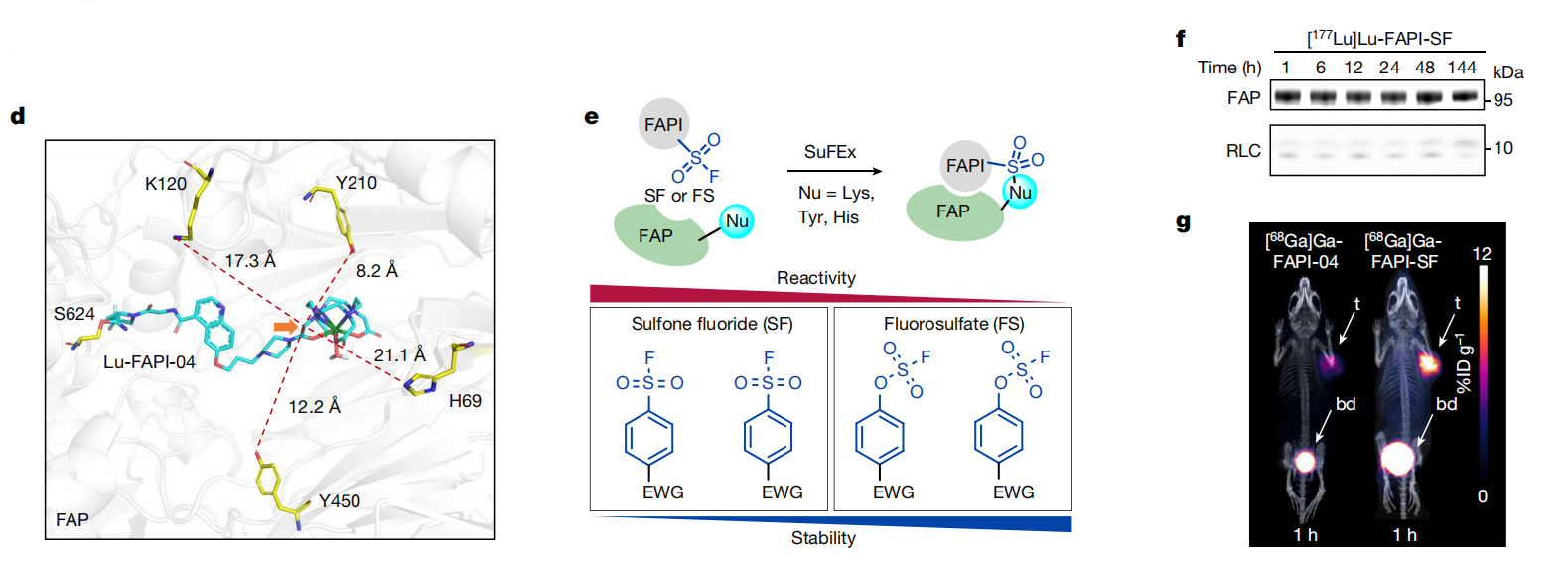
Fig.5
这第一次尝试表明共价放射配体策略是有前景的。然而,稳定性实验表明,超过50%的FAPI-SF在磷酸盐缓冲盐水中被水解,这表明SF对此存在过度反应性,导致不理想的脱靶。
CTR-FAPIs 与 FAP不可逆结合
02
研究人员随后开始寻找具有较低反应性但更高的体内稳定性和更好的肿瘤靶向性的替代FS弹头。
合成了两种新的CTR-FAPIs,具有吸电子酰胺取代FS的FAPI-pFS 以及 FAPI-mFS,具有理想的稳定性,并用68Ga或177Lu进行放射性标记。体外试验显示,FAPI-pFS和FAPI-mFS与FAP具有高效且稳定的不可逆共价结合。(Fig.6)
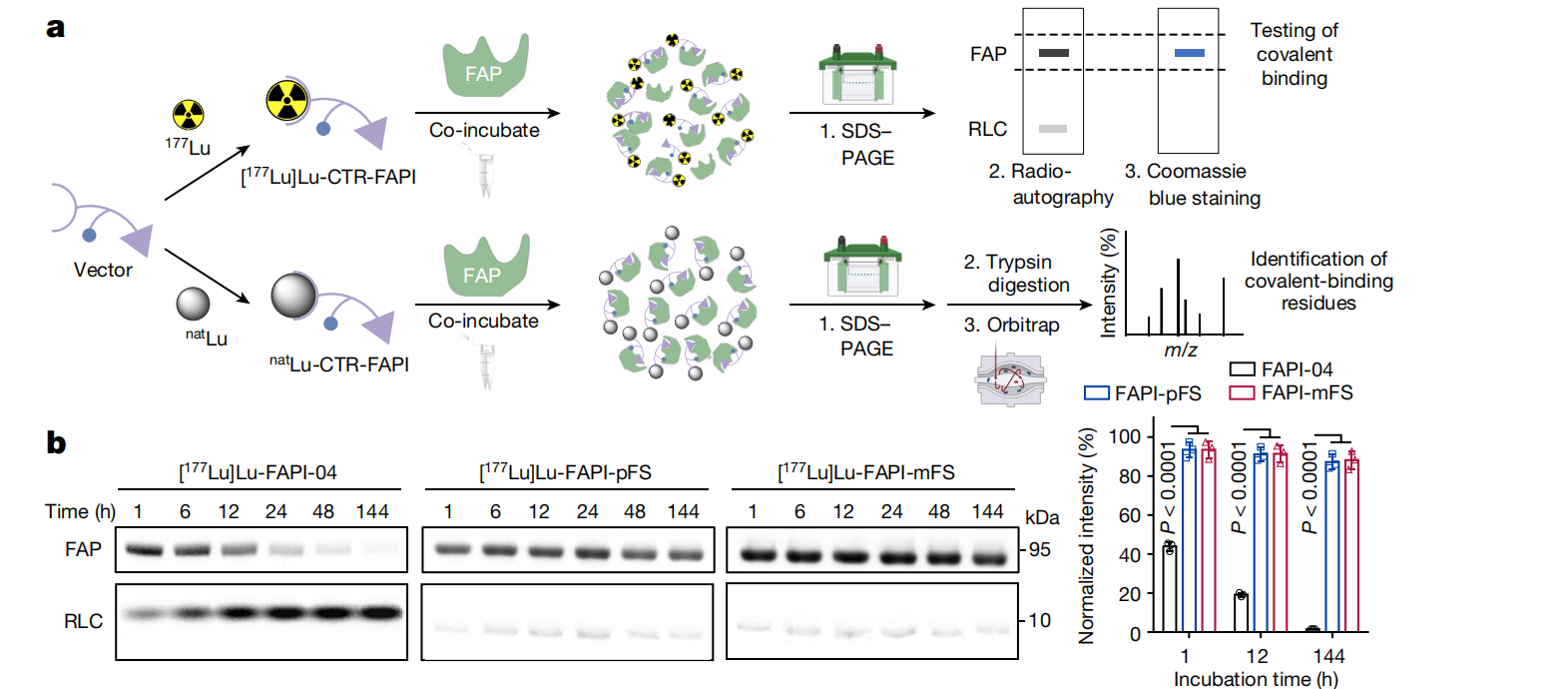
Fig.6
研究人员提出可以通过活性蛋白质组学的方法来识别FAP上的其他潜在反应性氨基酸残基,对现有的次优SuFEx弹头进一步改进,从而开发出与FAP结合更紧密、更不易脱落的SuFEx弹头,提高FAPI的肿瘤靶向性和疗效。
他们用聚丙烯酰胺凝胶电泳(SDS-PAGE)纯化了natLu-FAPI-pFS(其中上标“nat”表示天然或非放射性)或natLu-FAPI-mFS连接蛋白复合物,用于胰蛋白酶裂解,并收集了相应的串联质谱,下图列出具有代表性的修饰残基。
在SuFEx反应后,Y210和Y450被natLu-FAPI-pFS或natLu-FAPI-mFS修饰为Lu-FAPI-pFS-Y210-FAP和Lu-FAPI-mFS-Y450-FAP配合物。分子动力学(MD)模拟进一步证明了这些连接的稳定性。
研究人员还在单循环模式下进行了表面等离子体共振(SPR),进一步对比分子-靶标相互作用动力学。其结合速度以及解离速率均表现出优势。
对孵育后细胞中提取的总蛋白进行了SDS-PAGE放射自显影分析。所示FAPI-pFS和FAPI-mFS与细胞上的FAP有效且牢固地形成共价键。且共价结合可以有效地增加放射配体的细胞摄取和保留。另外,研究人员还通过外排实验检测FAPI的细胞保留情况。FAPI-pFS和FAPI-mFS的半衰期比FAPI-04的半衰期长13.9倍。(Fig.7)
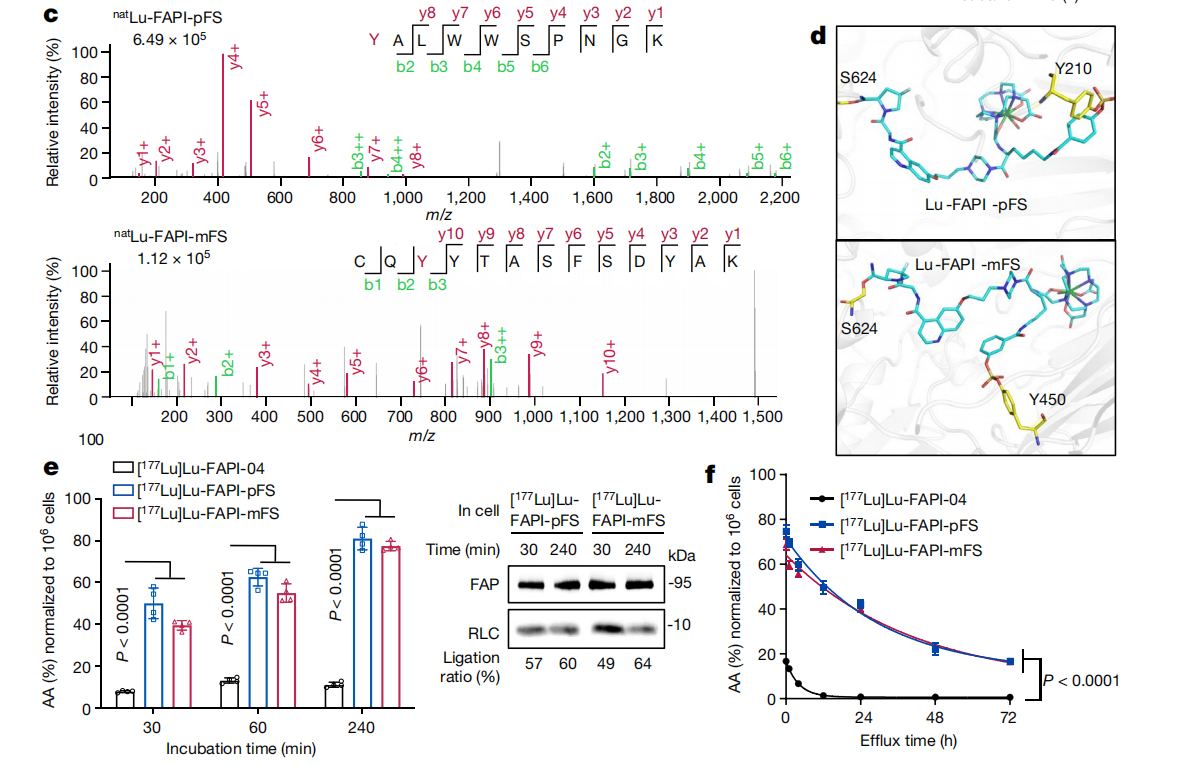
Fig.7
后续研究人员还合成了荧光探针FAPI-AF488-mFS来辅助验证实验结果,通过可视化细胞摄取和外排,表明SuFEx工程可以增加FAPI及其衍生物的细胞摄取和保留。然而,CTR-FAPIs 是否可以利用肿瘤对FAP靶向放射配体(如FAPI-04)的摄取,从而在动态血液循环的荷瘤小鼠中有效地锚定FAP,至此尚不明晰。
PET影像学对比
03
通过其高选择性以及高度亲水性和多电荷螯合剂的作用(例如DOTA),确认细胞内靶标脱靶的可能性不大。
还通过人血清和小鼠血液培养以及尿稳定性试验,表明SuFEx工程,特别是mFS,可能不会在健康组织中引起脱靶共价结合。
在相同的荷瘤小鼠中对[68Ga]Ga-FAPI-04和[68Ga] GA - FAPI - pFS(或[68Ga]Ga-FAPI-mFS)进行了头部PET/CT成像。注射后1小时,[68Ga]Ga-FAPI-pFS和[68Ga] Ga-FAPI-mFS的肿瘤摄取明显高于FAPI-04 ,最大SUV (SUVmax)分别增加92%和257%,且清除是快速的,主要通过肾脏系统进行。体外生物分布显示,[68Ga]Ga-FAPI-mFS的肿瘤摄取明显高于[68Ga]Ga-FAPI-pFS和[68Ga]Ga-FAPI-SF,但主要器官的总体摄取较低。这些结果表明FAPI-mFS可用于后续的TRT。
将FS水解为硫酸氢制备出FAPI-mHS。[68Ga]Ga-FAPI-04、[68Ga]Ga-FAPI-mHS和[68Ga]Ga-FAPI-mFS的荷瘤小鼠PET/CT成像研究,显示[68Ga]Ga-FAPI-mFS摄取率最高,提示共价结合SuFEx是增加肿瘤摄取的关键。
且在荷瘤小鼠体内可以观察到肿瘤中FAPI-mFS与FAP的共价结合,这是有希望的临床前数据。在随后的临床研究中,与FAPI-04相比,FAPI-mFS的确在甲状腺髓样癌患者中的PET/CT成像中能够识别出更多的肿瘤病灶。(Fig.8)
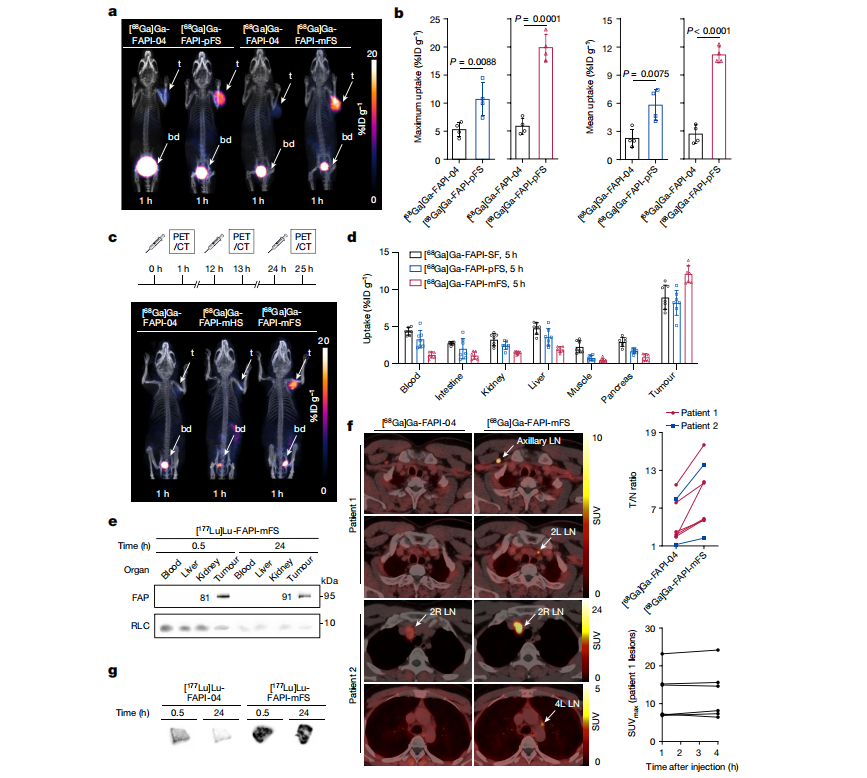
Fig.8
CTR通过提高保留率来增强FAP-TRT
04
在FAPI-mFS治疗的长期药代动力学研究中,[177Lu]Lu-FAPI-04和[177Lu]Lu-FAPI-mFS在荷瘤小鼠中的生物分布,证明了FAPI-mFS在肿瘤中的良好靶向性和滞留性。
根据生物分布,通过OLINDA软件计算[177Lu]LuFAPI-mFS治疗HT-1080-FAP肿瘤的有效剂量为890 mGy MBq−1。小鼠实验以及肿瘤摄影证实了[177Lu]Lu-FAPI-mFS的明显抗肿瘤作用。这些发现表明,治疗性的 CTR-FAPI 在小鼠中具有良好的耐受性,强调了这种治疗策略的生物学安全性。(Fig.9)
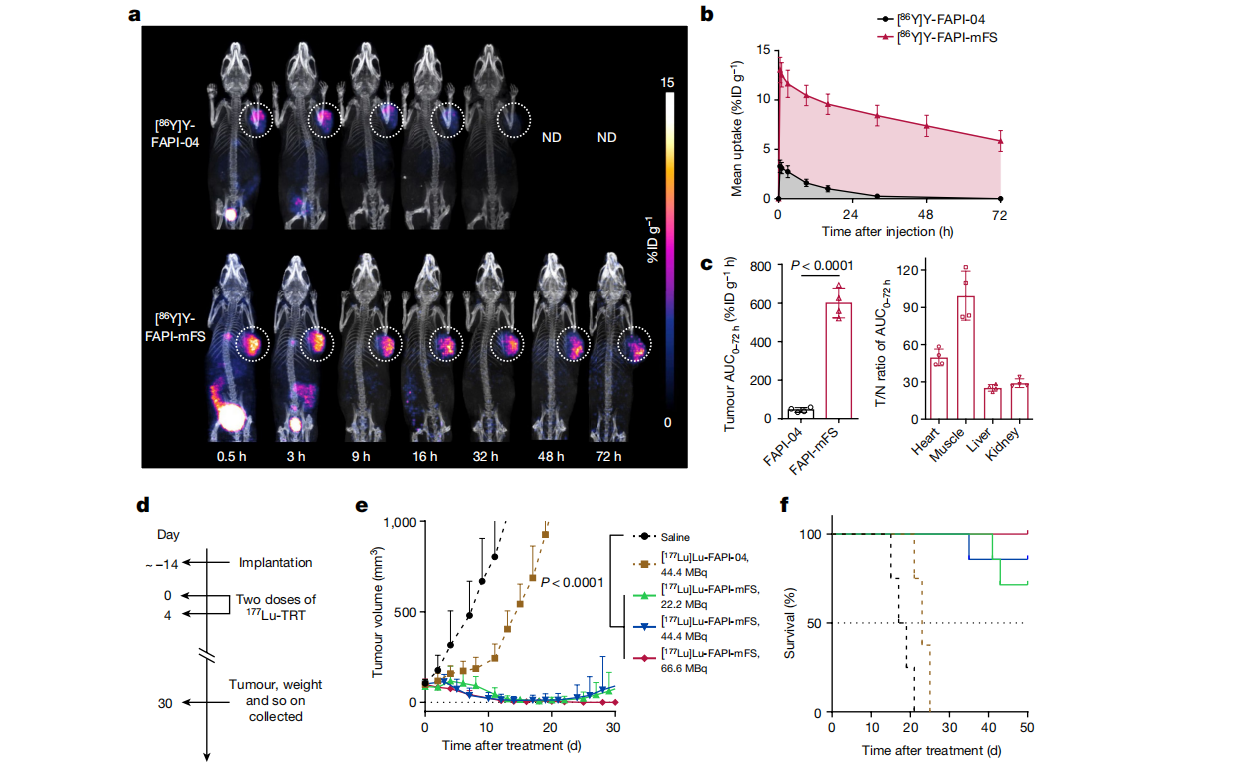
Fig.9
CTR的适用性
05
α-发射器225Ac 是放射性核素治疗的重点研究方向之一,其优越的疗效已在临床得到证实。研究人员研究了FAPI-mFS在靶向225Ac治疗中的潜力。
通过对来自唾液管癌患者的异种移植物模型(SDC-PDX模型)的免疫组织化学分析以及PET/CT成像,显示FAPI-mFS仍显著增加肿瘤摄取。并且在[225Ac]Ac-FAPI-mFS治疗的PDX小鼠组中观察到明显的肿瘤抑制。(Fig.10)
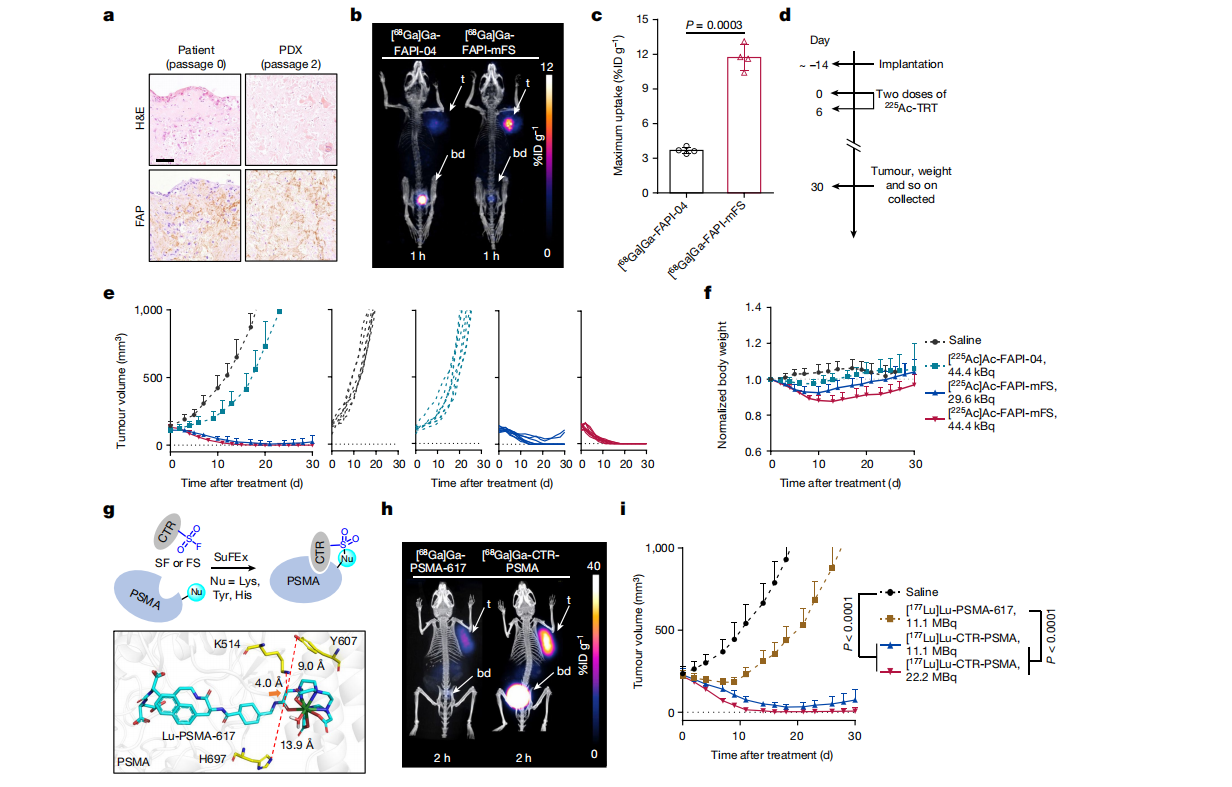
Fig.10
此外,研究人员还评估了[225Ac]Ac-FAPI-mFS治疗的潜在副作用:
1、靶向225Ac治疗可在治疗后的最初几天引起急性体重减轻,但小鼠在一周后恢复。康复率可能与治疗剂量有关。
2、全血细胞计数和血液生化检查显示,225Ac治疗后白细胞和血小板计数下降,这并不严重,是其他放射配体治疗常见的副作用。
3、血红素和伊红(H&E)染色分析表明,高剂量[225Ac]Ac-FAPI-mFS可能导致肝脏和肾脏急性但可恢复的损伤。
据报道,在SuFEx反应中可引起不可逆结合的残基包括赖氨酸、酪氨酸和组氨酸,这表明广泛的靶标可能与SuFEx形成共价键。作为概念验证,研究人员将这种CTR策略应用于设计[177Lu]Lu-PSMA-617 (Pluvicto),其靶向前列腺癌细胞上的前列腺特异性膜抗原(PSMA)。不出意料,设计出的组合物实验结果与上类似。
DISCUSSION
•
✦
研究讨论
✦
•
在这项研究中,研究人员发现放射配体的肿瘤靶向性和药代动力学可以通过使用SuFEx工程连接体进行全面优化。实验结果表明,在荷瘤小鼠中,SuFEx工程的小分子偶联物,如FAPI- mFS,与原始FAPI相比,可以在肿瘤积累增加近13倍,其余的通过肾脏系统迅速排出。且试点蛋白口袋筛选表明,活性残基广泛应用于许多临床重要靶标。这一强有力的策略将有望使研究人员和制药行业开发出具有小分子、多肽、适体或抗体片段的肿瘤靶向偶联物。
参考文献
[1] Cui, XY., Li, Z., Kong, Z. et al. Covalent targeted radioligands potentiate radionuclide therapy. Nature (2024). https://doi.org/10.1038/s41586-024-07461-6
PROFILE
刘志博
北京大学 化学与分子工程学院
北京大学 北大-清华生命科学联合中心
教授,博士生导师,国家杰出青年基金获得者
研究兴趣:
1、活体化学及其驱动的蛋白激活及药物释放;
2、罕见病的影像诊断探针及临床转化研究;
3、中子捕获治疗药物及其辐射生物学效应;
4、新型医用核素的生产工艺研究与临床应用。
END
文案 | 姜笑南
排版 | 姜笑南
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
