

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
药物滥用会导致突触传递和神经环路功能的长期变化,从而促使药物使用障碍的发展。研究表明神经环路可塑性可以通过髓鞘可塑性(Myelin plasticity)变化介导。髓鞘(Myelin)是由少突胶质细胞(Oligodendrocyte cells)形成的脂肪鞘,包裹神经元的轴突使之绝缘。轴突上髓鞘片段的数量和结构可以响应神经元活动而发生改变,这种现象被称为髓鞘可塑性。髓鞘可以增加神经冲动沿轴突的传递速度,因此髓鞘可塑性变化会影响神经环路的动力学变化进而导致行为改变。
研究目的
Objectives
本文研究希望检验阿片类滥用药物如吗啡引起的奖赏神经环路功能的改变也涉及髓鞘可塑性变化这一假设,进一步研究药物滥用改变奖赏环路功能的机制,从而寻找治疗药物使用障碍的潜在新靶点。
METHODS
•
✦
研究方法
✦
•
1. 光遗传学技术
光遗传学(Optogenetic)是结合了光学(Optic)及遗传学(Genetic)的技术,可在活体动物甚至是自由运动的动物脑内精准地控制特定种类神经元的活动。光遗传学在时间上的精确度可达到毫秒级别,在空间上的精确度则能达到单个细胞级别。
2. 条件性位置偏爱模型
条件性位置偏爱模型可以将药物带来的奖赏刺激与特定的场景进行偶联,形成经典的巴普洛夫条件反射。本文研究中使用该模型研究阿片类滥用药物如吗啡的奖赏学习。
3. 光纤记录
光纤记录系统是一种基于光学原理的技术,该系统的工作原理是由LED光源发射出470nm波段的蓝色激发光,经二相色镜反射,被物镜耦合到一根多模光纤中,光纤末端将激发光传输到被试动物脑区,激发被GCaMP钙敏感荧光蛋白或其他敏感荧光探针所标记的神经元。本文研究中使用多巴胺探针和光纤记录技术监测不同情况下小鼠特定脑区多巴胺释放的变化。
FINDINGS
•
✦
研究发现
✦
•
1. 多巴胺能神经元活动调控少突胶质细胞增殖
研究团队首先通过光遗传学激活腹侧被盖区(Ventral tegmental area, VTA)中的多巴胺能(Dopaminergic, DA)神经元,发现可以诱导条件性位置偏爱(Conditioned place preference, CPP);同时VTA中的少突胶质细胞和少突胶质前体细胞增殖增加。进一步激活投射到伏隔核(Nucleus accumbens, NAc)的VTA脑区DA神经元末梢,发现VTA脑区而非NAc脑区中的少突胶质前体细胞增殖增加。(图1)
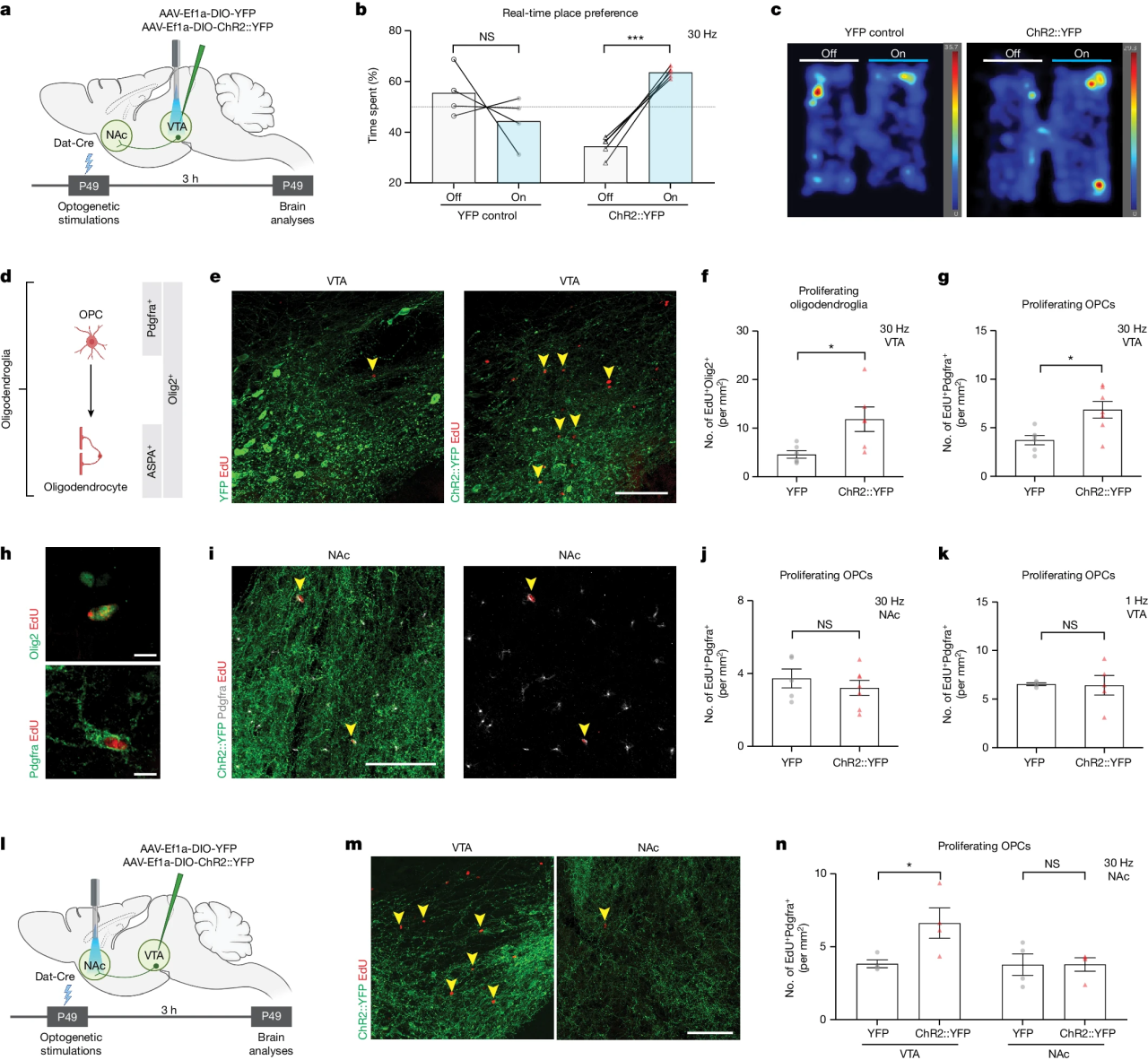
图1 奖赏环路中的多巴胺能神经元活动增加腹侧被盖区中少突胶质前体细胞增殖
2. 多巴胺能神经元活动调控髓鞘形成
研究团队进一步发现,激活VTA脑区的DA能神经元会显著增加VTA脑区而非NAc脑区中新生少突胶质细胞的数量;同时VTA脑区中髓鞘形成发生变化,有髓轴突的密度显著增加。(图2)
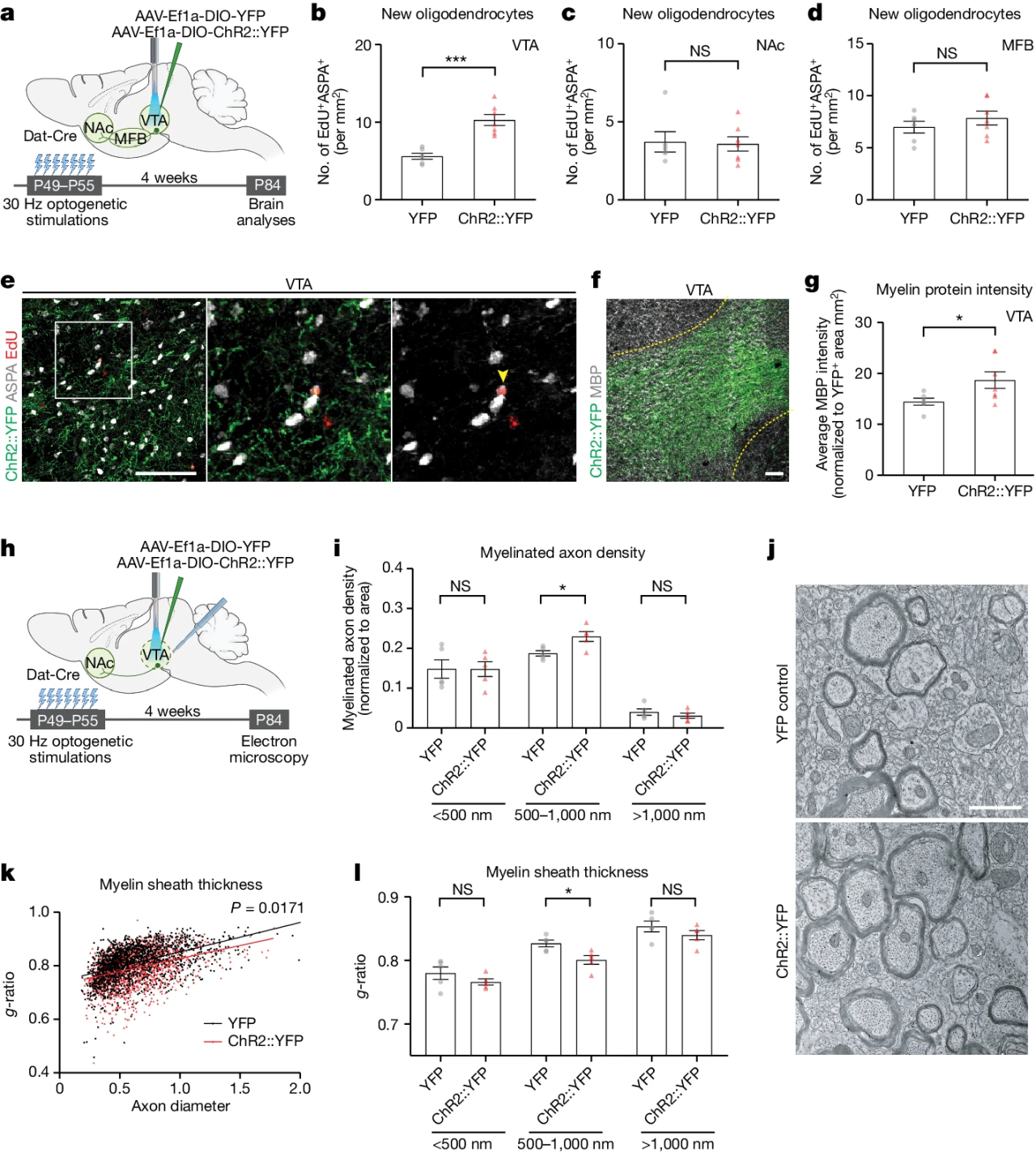
图2 多巴胺能神经元活动调控腹侧被盖区中的髓鞘形成
3. 药物奖赏中的少突胶质细胞再生
研究团队进一步使用成瘾物质吗啡或可卡因对小鼠进行腹腔注射,发现单次吗啡或可卡因注射后3h,VTA脑区中的少突胶质前体细胞增殖增加;同时,连续5天吗啡或者可卡因给药会导致小鼠行为敏化,同时可以诱导CPP的形成,这些行为学变化伴随着VTA脑区中的少突胶质前体细胞增殖。(图3)
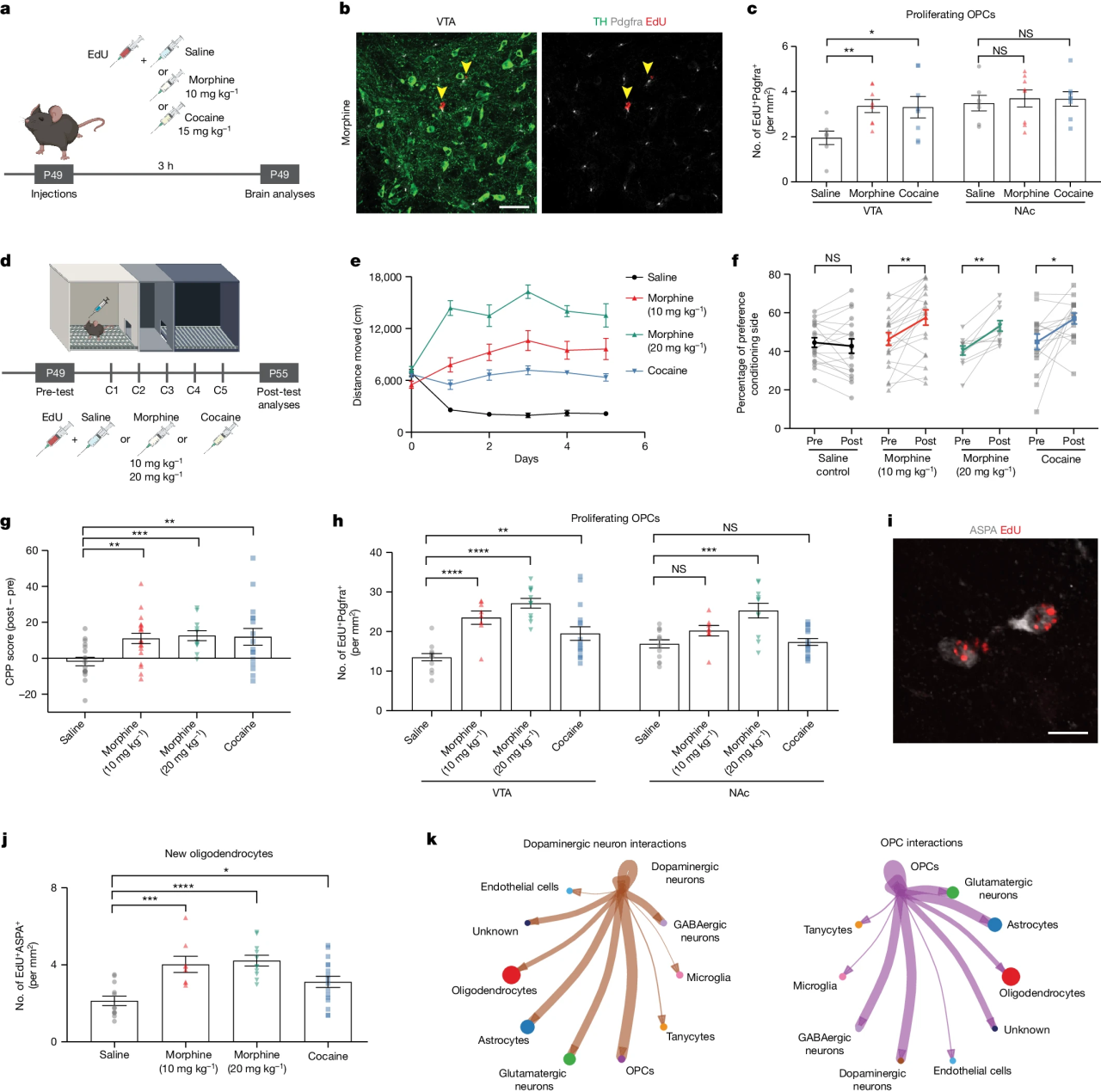
图3 吗啡和可卡因促进腹侧被盖区中的少突胶质细胞再生
4. 少突胶质细胞再生调节NAc中DA的释放
研究团队进一步通过诱导性敲除髓鞘调节因子(myelin regulatory factor, Myrf)阻断少突胶质细胞再生,结果显示敲除组小鼠连续5天吗啡给药后仍会诱导行为敏化,但不能诱导CPP的形成;同时少突胶质前体细胞增殖显著低于对照组小鼠。神经营养因子-酪氨酸激酶受体B(Bdnf-TrkB)信号通路是介导额叶皮层和胼胝体中调节少突胶质细胞再生的关键信号通路。研究团队进一步条件性敲除少突胶质前体细胞中的TrkB,结果显示敲除组小鼠连续5天吗啡给药后仍会诱导行为敏化,但不能诱导CPP的形成;同时少突胶质前体细胞增殖显著低于对照组小鼠。(图4)
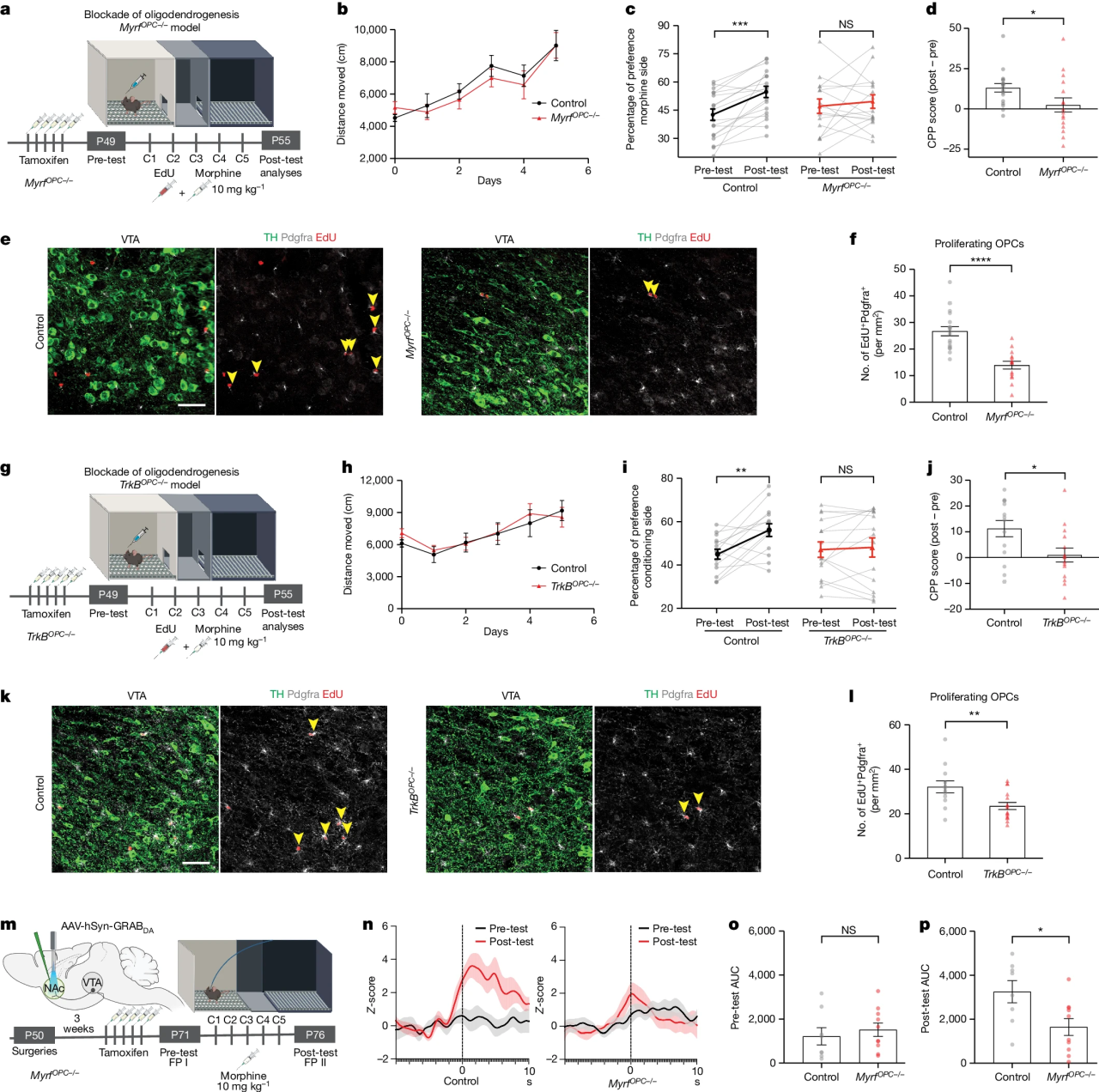
图4 阻断少突胶质细胞的再生抑制吗啡诱导的奖赏学习
DISCUSSION
•
✦
研究讨论
✦
•
本文研究首次发现髓鞘可塑性在奖赏环路和奖赏学习中发挥重要作用,髓鞘可塑性可以调节多巴胺释放;吗啡诱导奖赏环路中多巴胺能神经元活动进而驱动VTA中神经元轴突的髓鞘形成,进而调节吗啡觅药行为,这提示了髓鞘形成是阿片类药物使用障碍的潜在治疗靶点。
参考文献
[1] Yalçın B, Pomrenze MB, Malacon K, et al. Myelin plasticity in the ventral tegmental area is required for opioid reward. Nature. Published online June 5, 2024. doi:10.1038/s41586-024-07525-7
PROFILE
Michelle Monje
斯坦福大学小儿神经病学教授
Monje实验室研究出生后神经发育的分子和细胞机制。这包括微环境对正常神经发育和疾病状态下神经前体细胞命运选择的影响。重点领域包括神经胶质生成的神经元指令、细胞对神经源性和神经胶质生成信号微环境的贡献、神经前体细胞命运的分子决定因素以及神经前体细胞在肿瘤发生和修复机制中的作用。
END
文案 | 叶如枫
排版 | 叶如枫
审核 | 叶如枫
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
