

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
大量研究表明肿瘤免疫治疗(Cancer immunotherapy)在临床上能够显著提高病人的生存率。但是有部分病人对免疫治疗很快产生耐受,更有一些病人对免疫治疗不应答。所以,免疫治疗方案仍需进一步发展和完善。
肿瘤相关成纤维细胞(Cancer-associated fibroblasts ,CAFs)是在各种实体肿瘤TME中占比最高的非造血基质细胞群。研究表明,CAFs在TME中以多种方式促进肿瘤发展。部分研究表明,CAFs在TME中可以与Treg细胞相互作用,促进T细胞增殖,但是目前并没有确切的证据能够证明CAFs影响T细胞对肿瘤的免疫应答。
研究目的
Objectives
此研究通过使用多种肿瘤动物模型和实验技术探究CAFs调控T细胞抗肿瘤免疫的具体机制。
METHODS
•
✦
研究方法
✦
•
1 | 通过构建肿瘤模型和共培养,使用流式细胞术、透射电镜 、免疫荧光和3D成像等实验技术探究α-SMA+CAFs对肿瘤抗原的处理和提成及与T细胞的相互作用。 |
2 | 使用转录组学和蛋白组学探究自噬调控α-SMA+CAFs抗肿瘤免疫和向Treg细胞提成抗原的机制 |
3 | 通过使用基因缺陷鼠构建肿瘤模型探究α-SMA+CAFs自噬在肿瘤免疫检查点抑制剂(ICI)治疗中的作用。 |
FINDINGS
•
✦
研究发现
✦
•
1
部分清除α-SMA+CAFs促进肿瘤消退并减少TME中CD4+
Foxp3+ Treg浸润
在肿瘤发展过程中,部分清除α-SMA+CAFs导致肿瘤消退和抗肿瘤免疫增强,其特征是肿瘤内CD4+Foxp3+Treg细胞聚集减少(图1)。
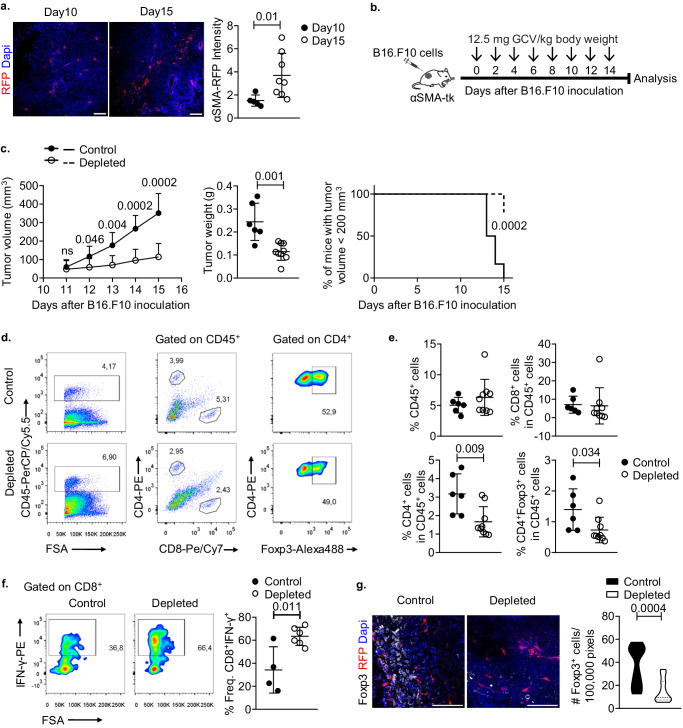
图1 部分清除α-SMA+CAFs促进肿瘤消退并减少TME中CD4+Foxp3+ Treg浸润
2
在TME中,α-SMA+CAFs与CD4+Foxp3+ Treg形成免疫突触
在TME中,α-SMA+CAFs与CD4+Foxp3+Treg细胞形成免疫突触,并以抗原特异性方式激活并促进Treg细胞增殖(图2)。
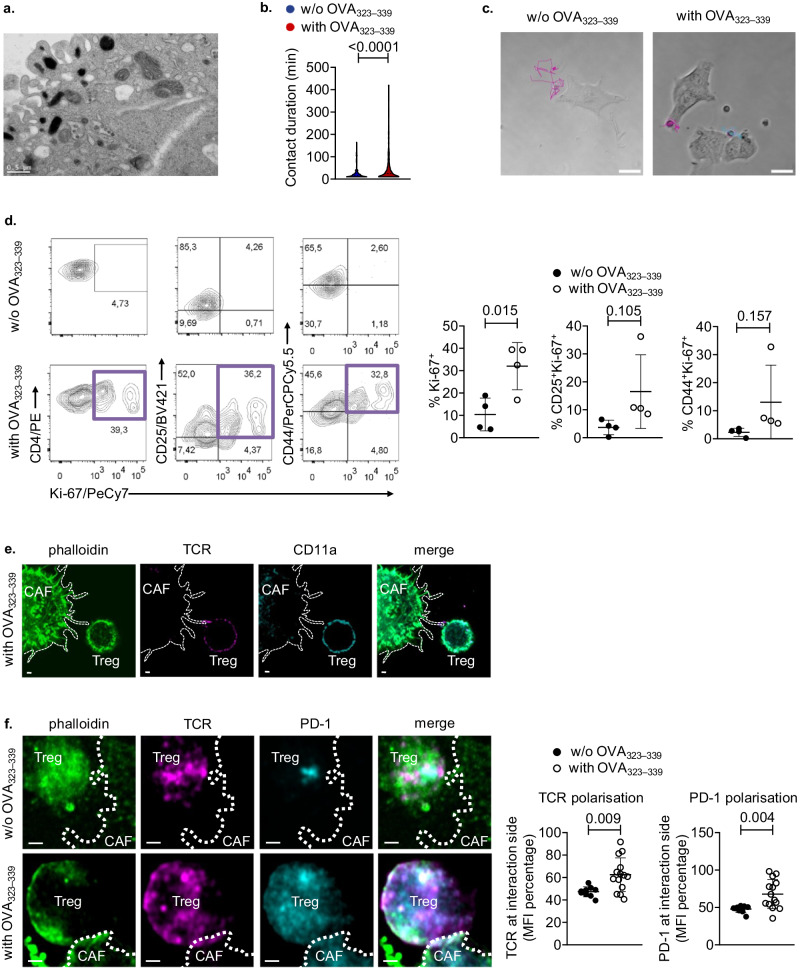
图2 α-SMA+CAFs与CD4+Foxp3+ Treg以抗原特异性方式形成免疫突触
3
在TME中,α-SMA+CAFs通过自噬发挥抗肿瘤免疫
通过对已发表的肿瘤组织单细胞转录组测序数据进行meta分析发现,α-SMA+CAFs高表达抗原提呈相关基因,如:Cd74、H2-Aa、H2-DMa和H2-DMb1,这一结果印证了以往的结论:CAFs是非专职抗原提呈细胞。同时分析也发现,α-SMA+CAFs高表达自噬相关基因,如:Wipi1、Lamp2、Gabarapl1和Sting1(图3)。
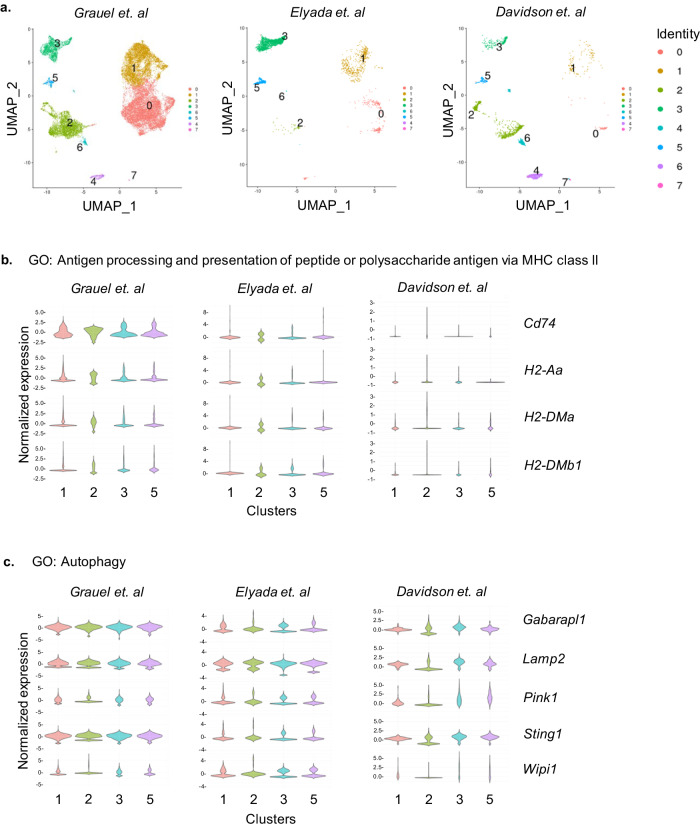
图3 自噬和抗原提呈相关基因在α-SMA+CAFs中富集
通过使用α-SMAcreAtg5fl/fl基因鼠构建肿瘤模型发现,废除α-SMA+CAFs的自噬能力后,显著抑制肿瘤生长,并降低TME中CD4+Foxp3+ Treg比例及其在α-SMA+CAFs周围的聚集(图4)。
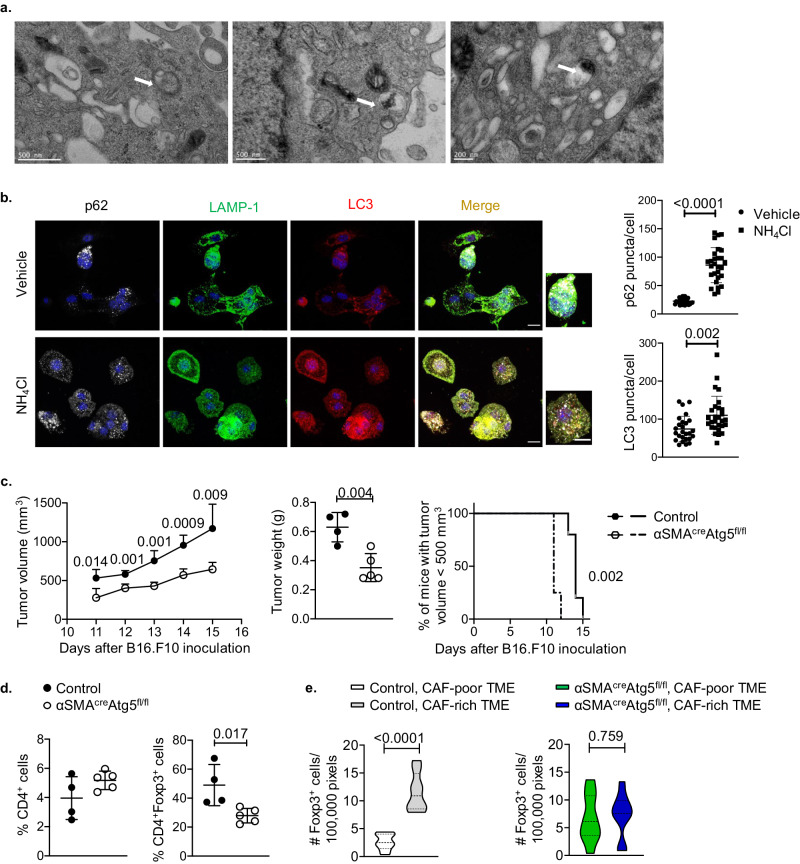
图4 条件性敲除自噬基因的α-SMA+CAFs促进肿瘤消退
4
失去自噬功能的α-SMA+CAFs转变为促炎表型并增强免疫检
查点抑制剂的治疗效果
分离TME中的α-SMA+CAFs进行转录组学和蛋白组学测序和分析发现,与对照组细胞相比,α-SMAcreAtg5fl/flCAFs的基因表达发生显著改变,涉及氧化磷酸化和细胞呼吸的相关基因表达下调,促进炎症发生的细胞因子、趋化因子及相对应的受体基因表达上调(如:Cxcl5、Cxcl16、 Cxcl13、Il34、Il18、Il18ra、Il6、Ifngr1、Ifnar1)(图5)。
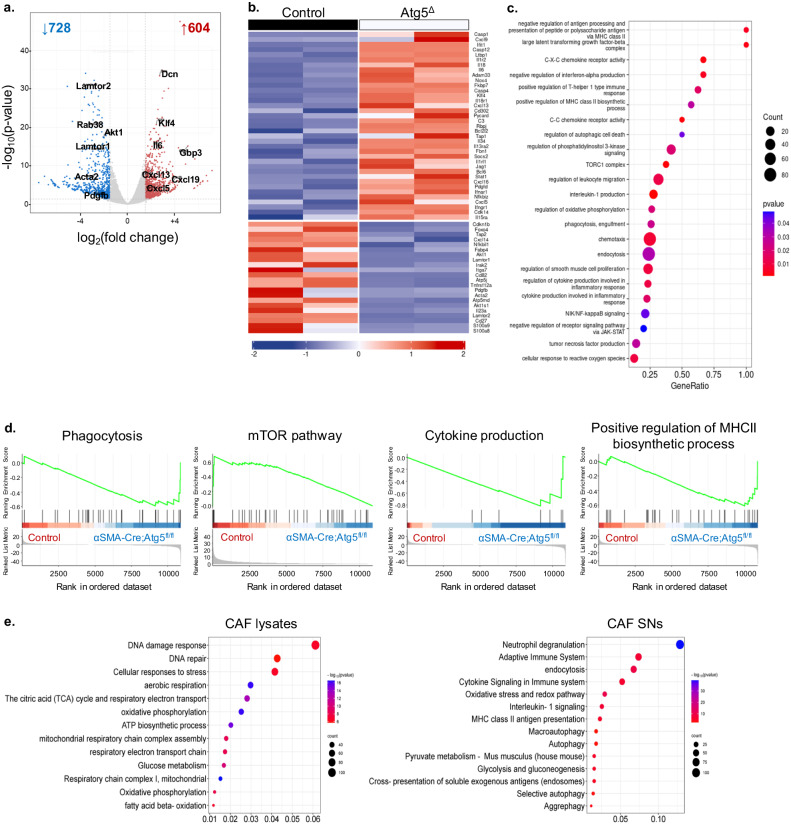
图5 失去自噬功能的α-SMA+CAFs转变为促炎表型
使用α-SMAcreAtg5fl/fl鼠和同窝对照构建肿瘤模型,并联合使用抗PD-1和抗CTLA-4治疗发现,与对照组相比,使用ICI治疗的的α-SMAcreAtg5fl/fl鼠肿瘤生长受到显著抑制,TME中浸润的CD4+Foxp3+ Treg显著减少(图6)。
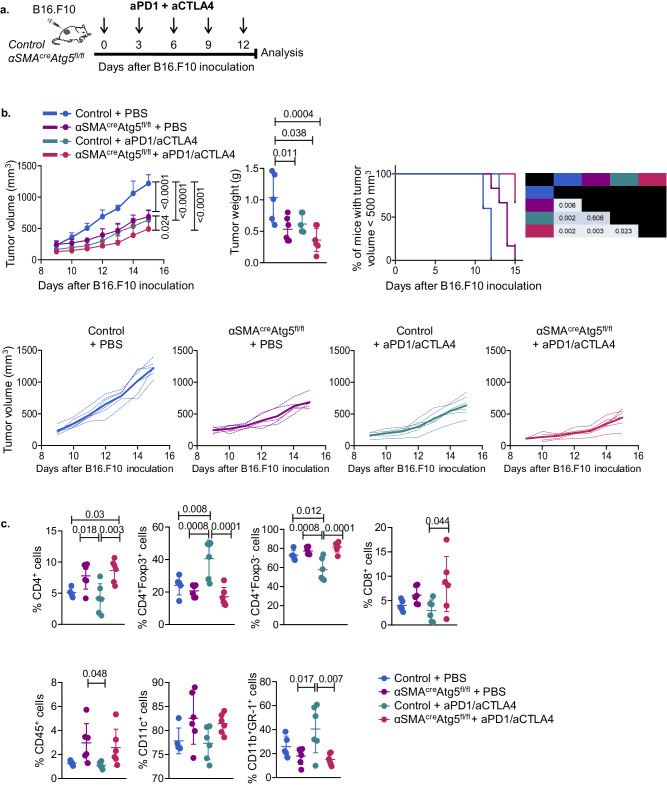
图6 失去自噬功能的α-SMA+CAFs增强ICI免疫治疗
DISCUSSION
•
✦
研究讨论
✦
•
这项研究表明α-SMA+CAFs通过自噬作用提呈肿瘤抗原,并与CD4+Foxp3+ Treg细胞形成免疫突触,塑造免疫抑制状态的TME。同时特异性废除α-SMA+CAFs自噬能力后,ICI治疗效果增强,这一发现为临床提供新的ICI治疗思路。
但是这项研究并没有探究废除α-SMA+CAFs的自噬能力后增强ICI治疗的具体机制。
参考文献
[1] Varveri, A., et al., Immunological synapse formation between T regulatory cells and cancer-associated fibroblasts promotes tumour development. Nat Commun, 2024. 15(1): p. 4988.
END
文案 | 王亚舒
排版 | 王亚舒
审核 | 王亚舒
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
