
INTRODUCTION
•
✦
研究介绍
✦
•

研究背景
Background
免疫检查点阻断(ICB)疗法(即抗pd -1/PD-L1和抗ctla -4检查点抑制剂)刺激宿主免疫系统,具有强烈的抗癌效果。然而,仅部分患者能够激活长期免疫反应,针对大部分患者的长期免疫激活仍然是一个巨大挑战。
有效的抗癌免疫依赖于免疫周期中的多个步骤,该周期始于肿瘤相关抗原(TAAs)首次被垂死的肿瘤细胞释放并被抗原提呈细胞(APC)捕获。随后,APC将捕获的抗原交叉呈递给T细胞,引发效应T细胞对TAAs的反应。这些被激活的效应T细胞定位并浸润到肿瘤组织中,特异性地杀死癌细胞,癌细胞释放更多抗原,在下一个周期中扩大免疫反应。
然而,癌症免疫周期通常在癌症患者中并不起作用,临床反应取决于肿瘤微环境(TME)。免疫抑制性TME患者(即所谓的免疫“冷”肿瘤),其特征是缺乏肿瘤浸润淋巴细胞、丰富的免疫抑制因子和不充分的突变负担,对ICB治疗反应较差。
因此,调节肿瘤周期免疫中的关键事件,将冷肿瘤转化为热肿瘤,长效激活机体的免疫反应对于癌症的治疗至关重要,而在进行治疗的同时,也要关注药物的全身毒性,降低副作用。
研究目的
Objectives
结合纳米颗粒配方和原位形成的水凝胶支架来治疗局部可触及的肿瘤,并刺激转移性肿瘤病变的全身免疫。
METHODS
•
✦
研究方法
✦
•
研究亮点
1 | 促进癌症免疫周期,并提供有效的化学免疫治疗 |
2 | 使用动力学激活纳米颗粒和水凝胶使小分子化疗和免疫刺激药物的时空递送成为可能 |
3 | 对肿瘤和淋巴细胞室增强免疫反应,同时减少不良全身毒性的可能性 |
一、 原位水凝胶结构
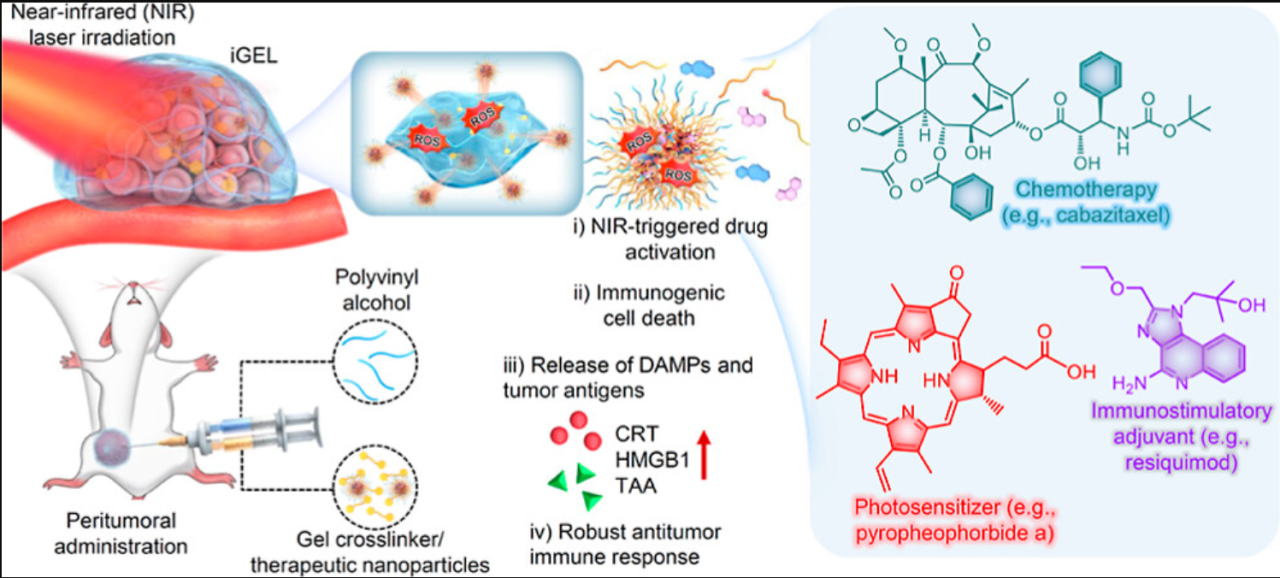
图1
PCL是一种经美国食品和药物管理局批准的生物相容性和可生物降解聚合物,是药物衍生化的良好促进剂(图1)。
研究者采用了三步方案,包括合成聚合前药,将其配制成纳米颗粒,并将其加载到ROS反应水凝胶中以制备iGEL。搭载药物包括细胞毒性药物——卡巴他赛、TLR7/8激动剂——瑞昔莫特和光敏剂——PPa,被共价连接在PCL片段上。
1. 在卡巴他赛和瑞西莫特衍生物中加入了一个可ROS切割的硫代连接物,用于按需药物激活。
2. 将前体药物组装成由两亲性聚乙二醇(PEG) -PCL共聚物(例如PEG10k-b-PCL10k)组成的聚合物胶束进行增溶。在近红外激光照射下,邻近的PPa光敏剂会产生ROS,自发地切割硫酮连接剂释放活性剂。
3. 通过将聚乙烯醇(PVA)和胶束与rossensitive交联剂(TSPBA)快速混合,将可光激活的纳米颗粒掺入ROS响应水凝胶支架中。扫描电镜(SEM)分析显示,iGEL具有多孔结构,具有均匀分布的治疗性纳米颗粒。
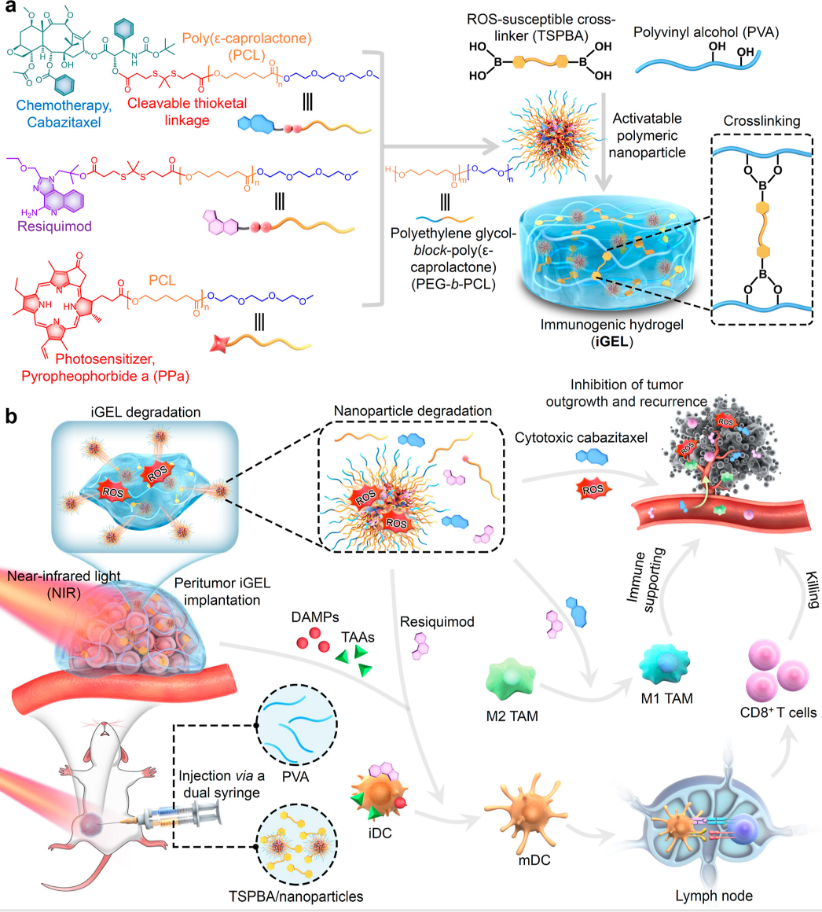
图2
研究者采用了猪皮肤试验确定iGEL的机械强度是否受到水凝胶组成的影响,在37℃下,机械强度随着时间的推移而增加,并在6 h时达到稳定。PVA投料百分比对凝胶的机械强度没有影响 (图2)。
同时将iGEL暴露于37°C的过氧化氢中,检测ROS敏感降解行为。随着H2O2浓度的增加,降解速度加快,3天后完全降解。因此,治疗性纳米颗粒的iGEL包封提供了ros反应性药物激活。此外,较高的H2O2浓度有利于药物的活化。
二、 iGEL体外诱导的强效细胞毒性及免疫激活
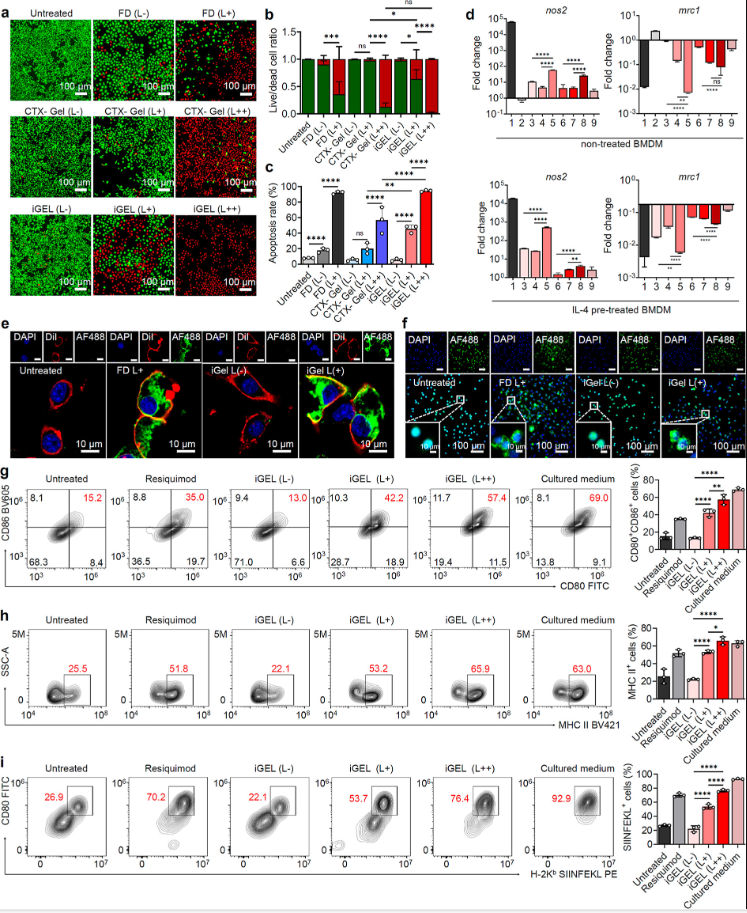
图3
为了探究该水凝胶的细胞毒性和体外免疫激活反应,研究者们通过活死细胞染色的方法验证了水凝胶经NIR照射后的细胞毒性;并考察了水凝胶将巨噬细胞由M2型复极化为M1型的效率,最后对免疫原性死亡效应进行考察,在BMDC上验证抗原提呈作用的激活,在此部分研究者发现(图3):
iGEL通过近红外激光照射诱导PPa−PCL包封后产生ROS和卡巴他赛细胞毒性增强,并与光动力学协同作用,提供卓越的治疗效果。
NIR触发卡巴他赛和瑞昔莫特的释放,以及近红外激光照射后ROS的产生,协同驱动巨噬细胞向肿瘤杀伤M1样表型发展,产生免疫活性的TME。
iGEL联合近红外激光照射触发了TLR7/8激动剂雷昔莫特的释放和ICD(免疫原性死亡)级联效应,诱导BMDC有效成熟和增强抗原呈递。
三、长效皮下滞留和按需激活
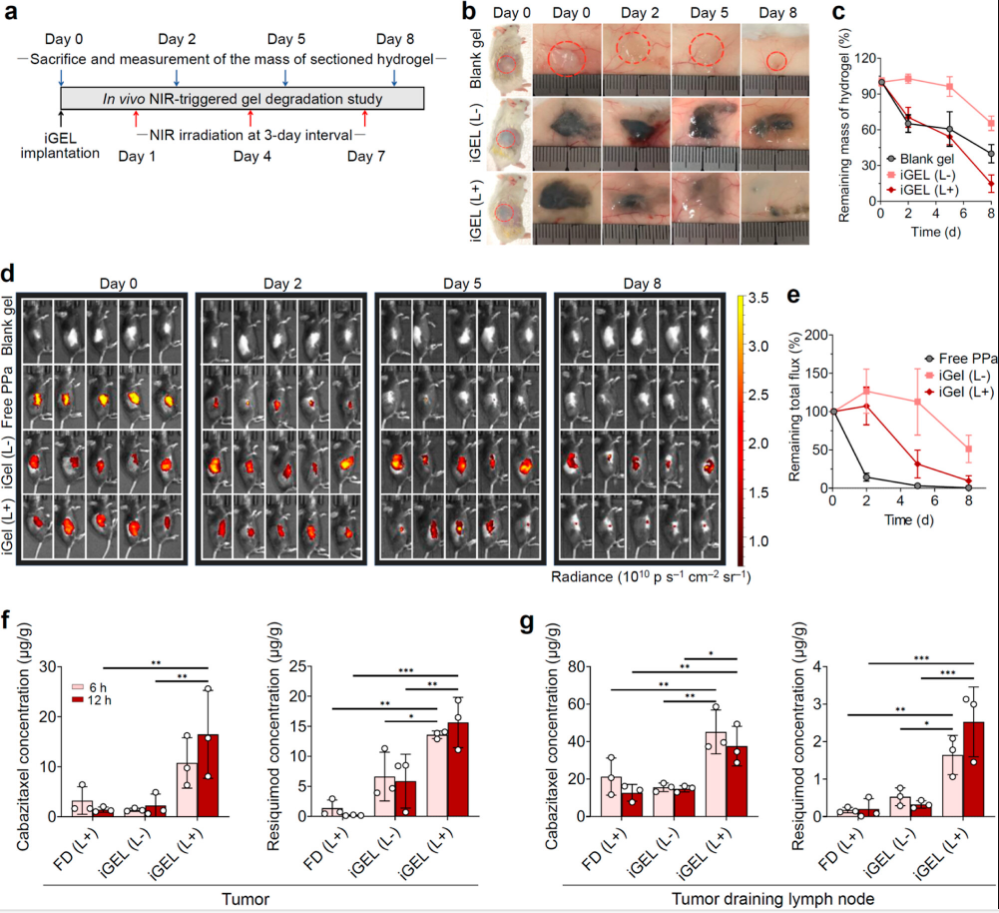
图4
研究者在小鼠皮下植入含有pva的聚合物纳米颗粒和TSPBA。聚合物纳米颗粒的包封延长了水凝胶的停留时间,无近红外激光照射8天后稳定。与空白凝胶相比,iGEL具有更多的ROS清除基团(如硫酮基团),这可能有助于iGEL在体内的缓慢降解动力学和延长保留时间(图4)。
iGEL植入8 d后观察到明显的荧光信号。然而,游离PPa处理后,注射部位的荧光强度急剧下降,在2天内信号几乎完全降解。近红外激光照射使iGEL的荧光信号迅速减弱,因为ROS响应凝胶坍塌。
这些结果表明,原位形成的iGEL是一种稳定的支架,可以延长局部药物保留并增加药物向TDLN和肿瘤的传递。值得注意的是,卡巴他赛在肿瘤中积累的增加有望产生更有效的肿瘤抑制作用,并可能导致TAM极化为杀肿瘤的M1样表型。同时,瑞喹莫特有效地递送至TDLN和肿瘤,使巨噬细胞协同极化和DC成熟,引发强大的肿瘤特异性T细胞反应。
四、抗黑色素瘤疗效
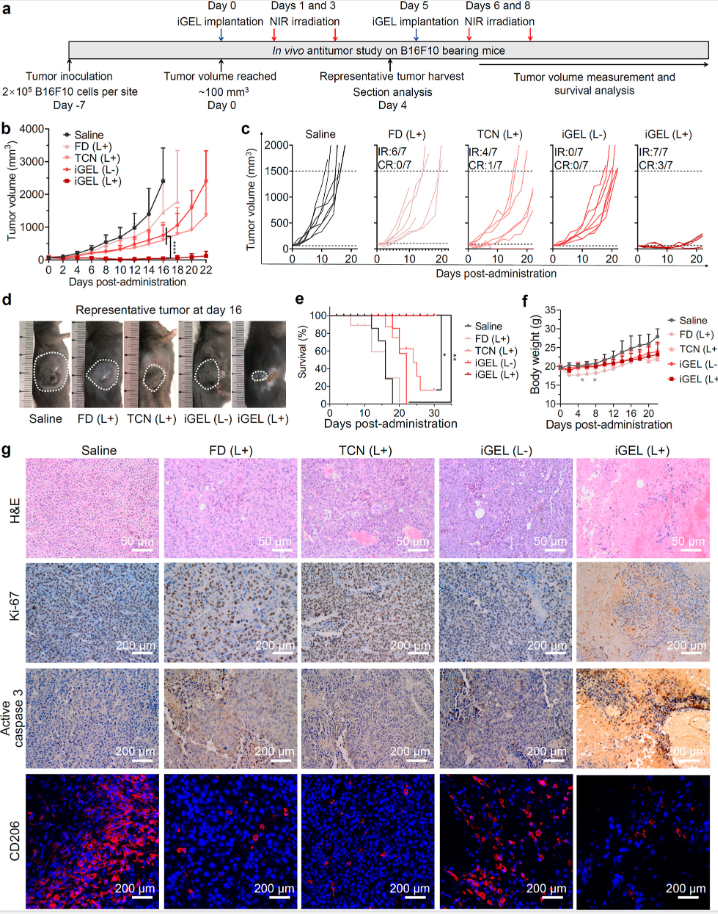
图5
经激光照射的游离药物联合治疗未能控制肿瘤生长,但其生存期与生理盐水对照组相似,这可能是由于药物在肿瘤和淋巴细胞室的积累有限。游离药物的全身毒性也较大,导致小鼠体重大幅下降(图5)。
在激光照射下,iGEL产生了明显的肿瘤抑制作用,42.9%的小鼠肿瘤消失,延长了总生存期。这种优越的活性可能归因于长期的局部保留,有效的药物激活和淋巴细胞室的递送。并且iGEL在动物身上安全性较高,因为动物体重平稳增长,并未出现体重急剧下降。H&E染色和免疫化学的组织学分析表明iGEL照射治疗引起了广泛的瘤内细胞凋亡和低细胞增殖。
这些结果表明,通过肿瘤周围给药局部三联iGEL治疗是一种有效且安全的抑制肿瘤进展的治疗策略。
五、全身免疫激活
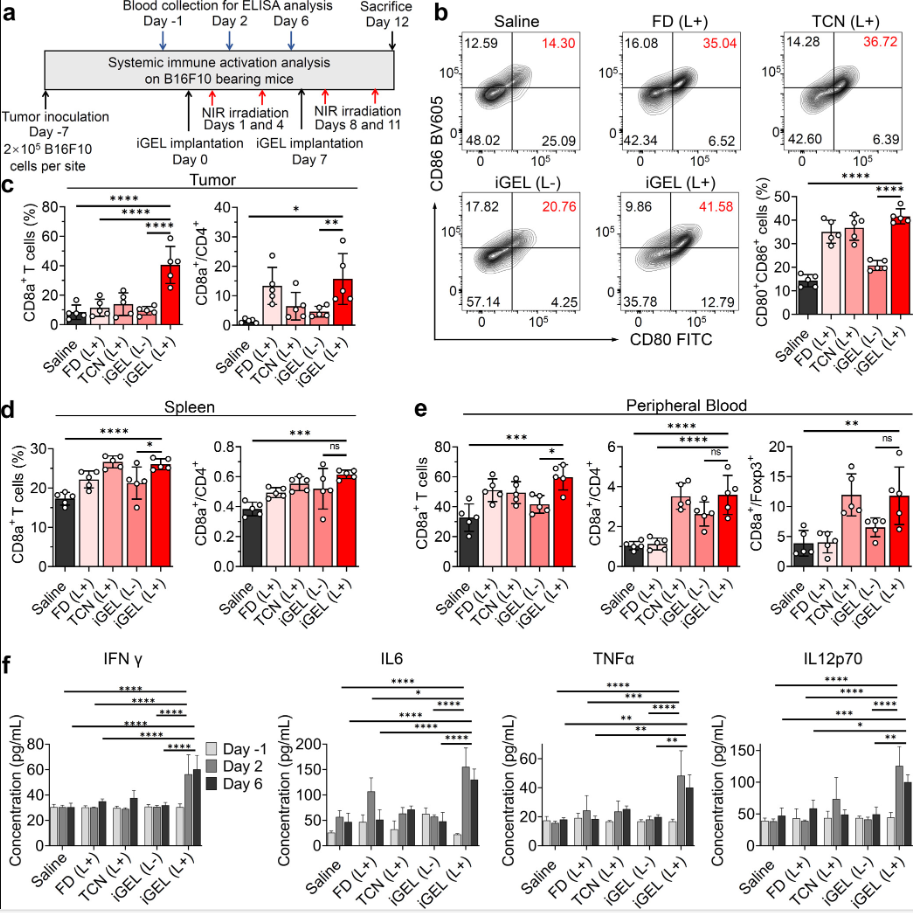
图6
通过流式细胞术考察,人员发现iGEL处理后再进行近红外激光照射可诱导TDLNs的DC成熟,并且可以有效提升CTL水平。在iGEL +激光照射治疗后,CD8+ / CD4+比值也显著升高。在脾细胞和外周血单核细胞的流式细胞术分析中也观察到类似的趋势(图6)。
另外,iGEL照射降低了外周血中免疫抑制调节性T细胞(Tregs, CD4+ CD25+ Foxp3+ T细胞)的比例,细胞毒性T细胞/ Tregs (CD8+ /Foxp3+)的比例从3.9%(生理盐水对照组)显著增加到11.8%。
促炎细胞因子,包括干扰素γ (IFN γ)、肿瘤坏死因子-α (TNF-α)、白细胞介素(IL)-6 (IL-6)和IL-12p,与免疫应答密切相关。研究者测量了治疗后这些免疫细胞因子的血清浓度。iGEL +激光照射治疗后,细胞因子分泌明显增加。与此形成鲜明对比的是,单独使用游离剂和纳米颗粒无法维持细胞因子的分泌,这可能是由于皮下注射后细胞因子会迅速消除。皮下植入iGEL可作为药物仓库,用于淋巴结和肿瘤导向的药物再填充和免疫激活。
这些发现还表明,iGEL支架和精确激光照射可诱导有效的适应性免疫反应,将免疫抑制性TME转化为免疫原性TME,从而改善预后。
六、激活强大的抗原特异性CTL反应
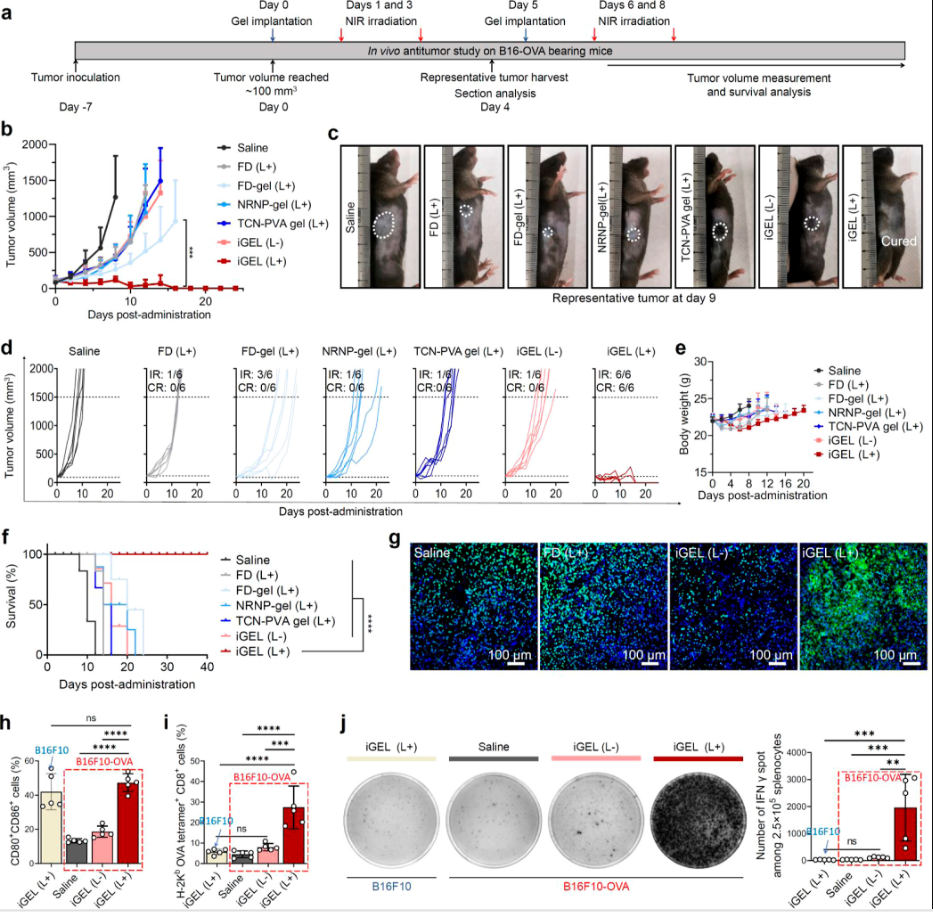
图7
近红外激光照射后,iGEL导致持久的肿瘤生长抑制,在所有小鼠中根除B16F10-OVA肿瘤,并延长无瘤总生存期至第40天。相比之下,所有其他治疗都显示出最小的治疗效果,并且肿瘤在治疗停止后不受控制地生长。同样,激光照射的iGEL在体内是安全的,没有观察到明显的体重减轻(图7)。
激光照射诱导的ICD效果较好,有望进一步促进肿瘤抗原特异性CTL反应,从而获得更好的治疗结果。
iGEL进行瘤周治疗后再进行近红外激光照射,均可触发DC成熟。细胞毒性CD8+ T细胞是有效抗肿瘤作用的关键。iGEL治疗后,在B16F10-OVA小鼠中观察到更高频率的OVA257−264 (SIINFEKL)特异性肿瘤浸润性CD8+ T细胞扩增。
总的来说,在B16F10-OVA小鼠中,与未照射iGEL或生理盐水治疗相比,光照射iGEL治疗产生了显著更高水平的分泌IFN γ的CD8+ T细胞。这些发现表明,局部iGEL治疗有可能引发肿瘤细胞死亡,并启动肿瘤抗原特异性免疫激活,从而促进癌症免疫周期。
七、抑制术后肿瘤复发和转移
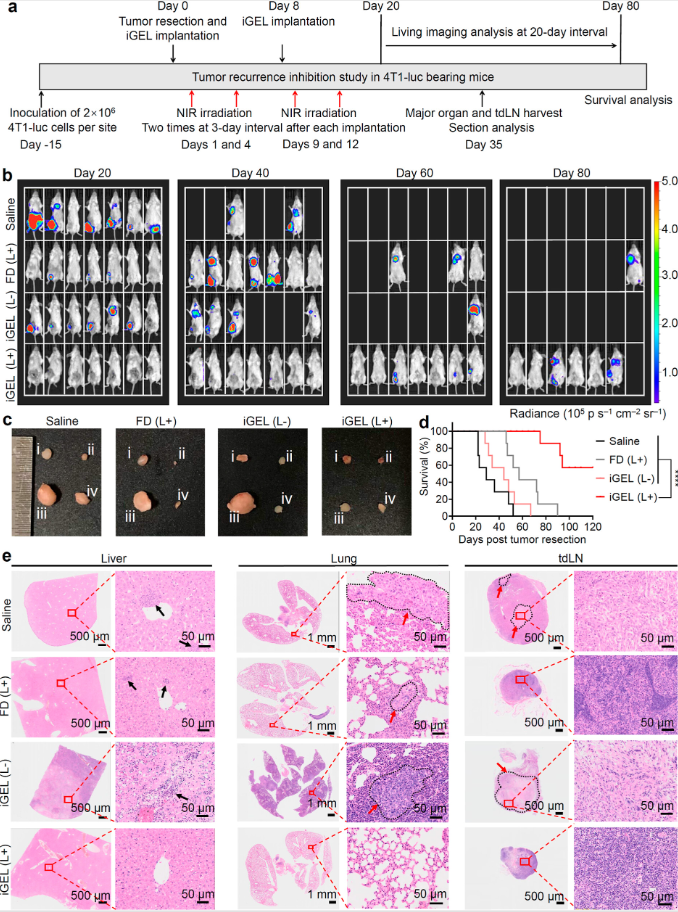
图8
肿瘤转移和复发经常发生在原发性肿瘤明显成功切除后,是癌症相关死亡的主要原因。这些事件可归因于肿瘤在难以接近或易感部位的不完全切除或肿瘤已经转移到远端器官(图8)。
研究人员考察了免疫调节水凝胶支架在肿瘤切除后局部应用于手术野附近时防止肿瘤复发的能力。在瘤周植入iGEL,然后进行靶向激光照射,可显著减缓肿瘤进展。该组的中位生存时间也显著延长至120天以上,而接受其他治疗的小鼠在90天内死亡。经生理盐水、游离药物和iGEL不辐照处理的小鼠,TDLN明显增大,表明肿瘤细胞明显逃逸和转移到该器官。此外,游离药物和iGEL单药治疗也未能阻止转移,肺中观察到4T1转移灶,肝脏中观察到炎症细胞侵袭。
在iGEL和激光照射治疗的小鼠中未观察到转移结节,证实了iGEL优越的抗转移预防作用。此外,肝脏或肾脏没有组织损伤的迹象,进一步支持了该组合支架在动物实验中的安全性。
FINDINGS
•
✦
研究发现
✦
•
1 | 化学工程聚合物前药纳米颗粒可以形成一种可注射的、肿瘤周围可给药的(也可喷雾的)水凝胶,以促进癌症免疫周期,并提供有效的化学免疫治疗。 |
2 | 使用动力学激活纳米颗粒和水凝胶使小分子化疗和免疫刺激药物的时空递送成为可能,对肿瘤和淋巴细胞室增强免疫反应,同时减少不良全身毒性的可能性。 |
3 | iGEL具有多种有利的特性,包括不同的纳米颗粒负载能力,时空控制的药物激活,降低全身毒性,值得进一步开发潜在的临床应用。 |
DISCUSSION
•
✦
研究讨论
✦
•
研究局限性
由于研究人员使用的近红外光的组织穿透深度有限(即660 nm),在体内的研究仅限于浅表肿瘤,如皮下黑色素瘤和原位乳腺癌。通过利用第二个NIR (NIR- ii)窗口在1000和1700 nm之间的近红外光,并扩大NIR- ii响应的连接物化学,还可以这种凝胶系统通过肿瘤周围重复给药来治疗深部癌症。
参考文献
[1] Syringeable Near-Infrared Light-Activated In Situ Immunogenic Hydrogel Boosts the Cancer-Immunity Cycle to Enhance Anticancer Immunity. Yang Fu, Xiaoxiao Zhu, Lulu Ren, Jianqin Wan, and Hangxiang Wang. ACS Nano 2024 18 (23), 14877-14892
DOI: 10.1021/acsnano.3c08425
作者简介
王杭祥
浙江大学医学院附属第一医院

2002年本科毕业于浙江大学材料与化学工程学院。
2006年获大阪大学(日本)工学研究科分子化学专业硕士学位。
2010年毕业于京都大学(日本)工学研究科合成生物化学专业,获工学博士学位。
现为浙江大学医学院附属第一医院卫生部多器官联合移植研究重点实验室PI,博士生导师
END
文案 | 郭蕊
排版 | 郭蕊
审核 | 郭蕊
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
