

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
阿尔茨海默病(AD),一种慢性神经退行性疾病,其特征是大脑中淀粉样蛋白-β(Aβ)沉积和血管功能障碍,包括血脑屏障的破坏。这导致血液蛋白质如纤维蛋白原渗入大脑。纤维蛋白原与Aβ的相互作用会恶化AD中的血栓形成和脑血管途径。
Lecanemab是一种已被FDA批准用于治疗AD的抗体疗法,能清除大脑中的Aβ斑块并减缓认知衰退。然而,关于Lecanemab的作用机制知之甚少。
研究目的
Objectives
该研究旨在探索Lecanemab如何阻止Aβ与纤维蛋白原的结合,以及它对Aβ诱导的突触毒性的影响。理解Lecanemab作为阿尔茨海默病治疗药物的可能保护机制。
METHODS
•
✦
研究方法
✦
•
1 | 使用生物素化的Aβ42原纤维与纤维蛋白原进行结合实验,评估Lecanemab的阻断效果。 |
2 | 分析Lecanemab对Aβ42/纤维蛋白原介导的延迟纤维蛋白溶解和血栓结构异常的影响。 |
3 | 小鼠器官切片培养中研究Lecanemab是否能减轻Aβ42/纤维蛋白原引起的突触损伤。 |
FINDINGS
•
✦
研究发现
✦
•
1 | Lecanemab剂量依赖性地阻止Aβ42与纤维蛋白原的结合,而人类IgG无此效果。(图1) |
2 | Lecanemab恢复了Aβ42引起的延迟纤溶,改善了由Aβ42导致的血液凝块结构异常。(图1) |
3 | Lecanemab修复了Aβ42对纤维蛋白组装的缺陷,减少了由Aβ42引起的纤维蛋白束变薄和不正常聚集。(图1) |
4 | 在体外实验中,Lecanemab抑制了Aβ42与纤维蛋白原的结合,当与Aβ42原纤维一起添加到正常人体血浆中时,Aβ42无法与纤维蛋白原结合。(图2) |
5 | 在小鼠器官切片培养的研究中,Lecanemab能够解离Aβ/纤维蛋白原复合物,防止纤维蛋白原加剧Aβ诱导的突触毒性。(图2) |
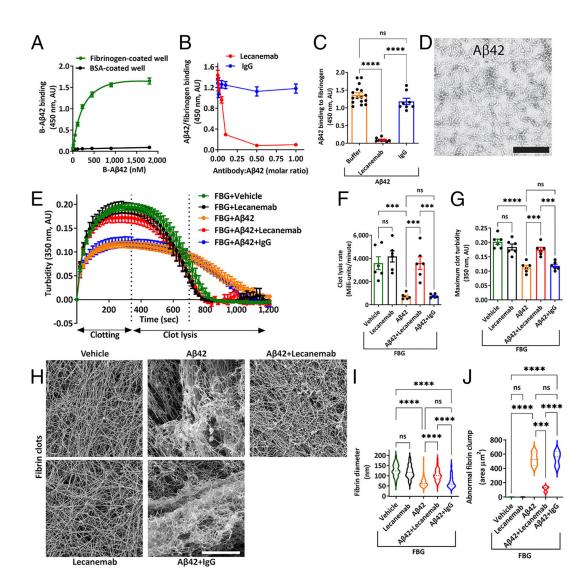
图1
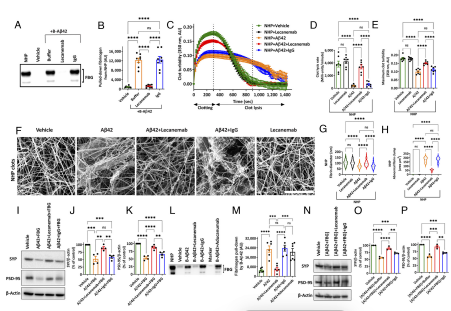
图2
DISCUSSION
•
✦
研究讨论
✦
•
研究展示了Lecanemab如何阻断并解离Aβ/纤维蛋白原复合物,保护血管和突触功能。揭示了Lecanemab可能减缓AD进展的潜在保护机制,具有重要的临床价值。
研究的局限性在于,研究者使用了高于治疗阿尔茨海默病患者脑脊液中浓度的lecanemab。这可能会影响其在体内解离Aβ/纤维蛋白原复合物以及清除这些复合物的效力的评估。此外,还需要进一步研究lecanemab在阿尔茨海默病小鼠模型和患者中的作用机制,特别是在减轻Aβ/纤维蛋白原诱导的突触毒性方面的具体机制。还应考虑血管内皮功能障碍和纤维蛋白(原)进入脑实质的神经退行性影响,这可能需要结合使用lecanemab和其他针对纤维蛋白或相关靶点的疗法来制定更有效的联合治疗策略。
参考文献
[1] Singh PK, Simões-Pires EN, Chen ZL, Torrente D, Calvano M, Sharma A,Strickland S, Norris EH. Lecanemab blocks the effects of the Aβ/fibrinogen complex on blood clots and synapse toxicity in organotypic culture. Proc Natl Acad Sci U S A. 2024 Apr 23;121(17):e2314450121. doi: 10.1073/pnas.2314450121.
Epub 2024 Apr 15. PMID: 38621133; PMCID: PMC11047064.
PROFILE
Dr. Erin H. Norris
Patricia and John Rosenwald Laboratory of Neurobiology and Genetics The Rockefeller University
诺里斯博士是纽约洛克菲勒大学神经生物学与遗传学实验室的研究副教授。她主要研究血管功能障碍在阿尔茨海默病病理生理学中的作用,以及如何将其用于开发新的生物标志物和治疗方法。
END
文案 | 李 蔓
排版 | 李 蔓
审核 | 李 蔓
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
