

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
转座子是能够在基因组不同位置移动的DNA片段。转座子广泛存在,并且已经显著影响了基因组多样性和进化。IS21家族是广泛存在于细菌中的转座子,已经被发现存在于临床上重要的多重抗药性菌株和人类病原体中。由于它们的简单而强的活力,IS21被作为机理研究的模型。IS21的典型序列包含两个反向重复序列(TIR),它还编码两个参与转座的重要蛋白,IstA和IstB。转座酶IstA需要调节因子IstB来进行转座。IstB是AAA+ ATPase家族的一个成员。它由一个N端延伸和ATPase结构域组成。虽然之前的研究已经体现了IstB能够自我聚合成一个二聚体的五聚体,并且IstB对于促进IstA催化的转座至关重要,但IstB是如何通过N端结构域二聚化并且如何特异性结合DNA使它弯曲还不清楚,IstB是如何招募IstA转座酶到DNA上并能够促进转座活动也还不清楚。
研究目的
Aim
1.探究核苷酸是如何调控IstA催化的转座的。
2.探究IstB具体如何结合DNA。
3.探究IstB如何促进IstA的招募与激活。
METHODS
•
✦
研究方法
✦
•
1 | 纯化分别在E. coli C41(DE3) 和 E. coli BL21codon-plus (DE3)中表达的来自G. stearothermophilus的全长的IstA和IstB。 |
2 | 体外整合反应被用来检测IstA/IstB对整合活性的影响。预切割的供体DNA分子为55bp长的双链,含有R-TIR,由一条转移链和一条非转移链构成。转移链末端为一个通常被转座酶攻击的活性3' OH的CA二核苷酸。非转移链包括一个5nt的5' overhang(图1)。体外整合反应是在含有MgCl2和ATP的HEPES缓冲液中进行的。IstA和供体DNA预先孵育,IstB和作为靶DNA的超螺旋质粒预先孵育。两者混合后在37摄氏度孵育15,30或60min,终止反应后样品进行琼脂糖凝胶电泳和显影。 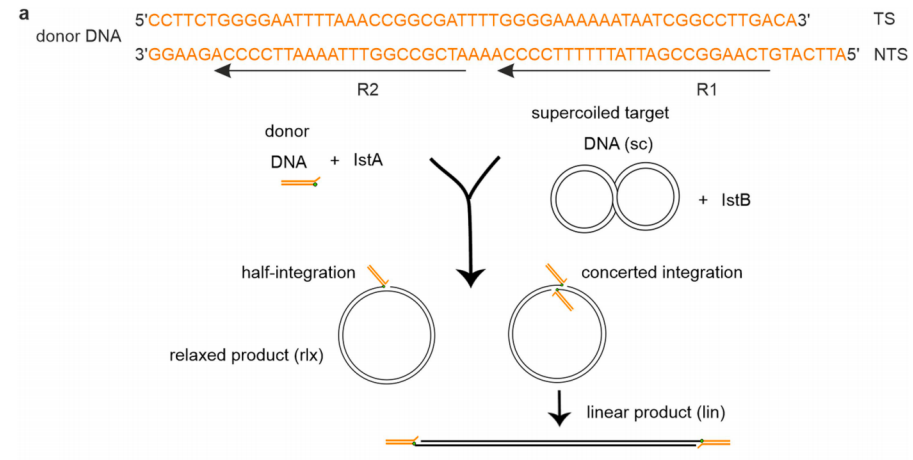 图1 体外整合反应示意图 |
3 | 无细胞转座反应被用来检测IstA突变体的转座活性。反应中有含MgCl2,DTT,dNTPs 和 ATP的反应缓冲液,纯化的IstA和 IstB,含IS21 TIR的供体质粒和E. coli BL21(DE3) 细胞提取物。反应在37摄氏度下孵育60min,相对于没有蛋白的对照,插入的频率由qPCR测定,引物对应了供体质粒和转座产物。 |
4 | ATPase反应被用来检测IstB的活性。ATPase反应是在含MgCl2和 ATP的HEPES缓冲液中进行。IstB单独加入或结合IstA加入。在37摄氏度孵育1h后,ATPase活性用磷酸盐检测试剂盒检测。 |
5 | 链转移复合物(STC) DNA的重建:STC DNA由三条单链DNA构成:130nt的TIR转移链包含了转座子右端TIR、插入序列和靶DNA序列;60nt的非转移链包含转座子右端TIR的互补序列和一个5nt长的5' overhang;靶DNA的互补序列。等摩尔量混合并退火三条单链DNA,然后加入IstA和IstB使其二聚化成为STC DNA。 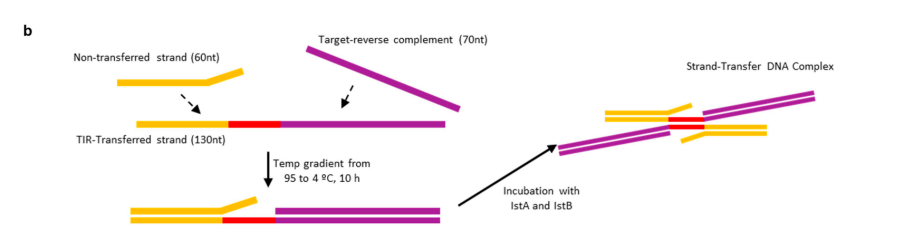 图2 STC的设计和组装示意图 |
6 | IstB-靶DNA复合物的形成和玻璃化:IstB和靶DNA相互混合,凝胶层析,对应IstB-DNA峰的成分被留下用于cryo-EM实验。 |
7 | IstA-IstB-STC 全转座体复合物的形成:IstA与STC DNA相互混合,在STC缓冲液中被稀释,37摄氏度孵育45min,再与在STC缓冲液中的IstB E167Q相互混合,在37摄氏度孵育30min。 |
FINDINGS
•
✦
研究发现
✦
•
1. IstB AAA+促进IS21转座
之前的研究表明IstB ATPase对于IstA促进DNA转座是必需的,但是核苷酸的结合和水解在IstA的招募、激活和DNA转座中的具体作用还不清楚。作者因此探究IstB催化活性如何调控IstA催化的转座。
首先,他们纯化了来自IS21家族成员的IS5376的已知对AAA+活性重要的ATPase突变体(如Walker A (WA), Walker B (WB), arginine finger (RF) 和 sensor II),然后测定了它们的整合活性。和之前的研究一致,结果显示IstB对于链转移是必需的,但IstB ATPase突变体仍然有整合活性(图3c)。
接下来他们想要进一步定义核苷酸在转座过程中的作用。他们用野生型IstB重复了转座实验。在ADP或慢慢水解的ATP类似物 ATPγS条件下,整合反应仍然能够进行但是被减弱,尤其是ATPγS(图3d)。总的来说,核苷酸转换对于IstB支持IstA促进转座有着重要功能。
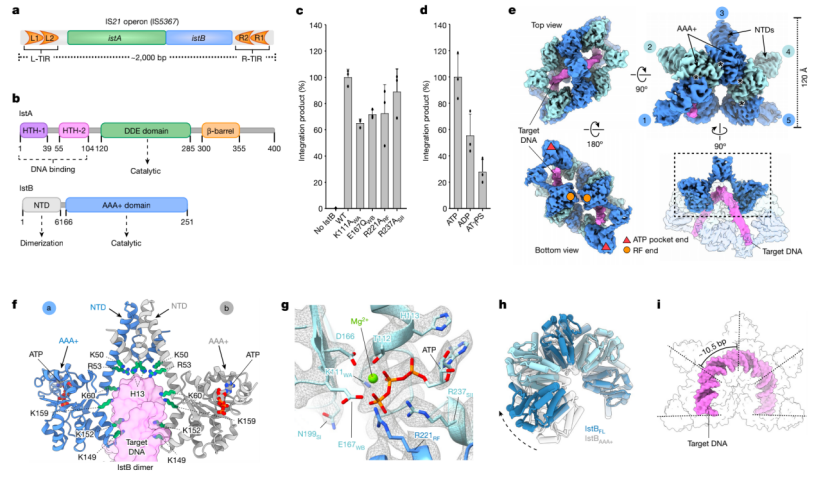
图3 IS21构成与IstB的结构和功能的鉴定
2.自我抑制的IstB改变双链DNA的构象
IstB具体如何结合DNA,活性位点在寡聚状态下如何防止ATP水解还不清楚。为了解决这些问题,cryo-EM被用来观察IstB在ATP存在的情况下结合DNA的结构。得到一个3.2 Å分辨率的结构后,发现cryo-EM图的质量允许AAA+ ATPase区域的晶体结构重建。他们也进行了蛋白N端及其靶DNA的从头构建模拟,产生了一个IstB-ATP-靶DNA复合物模型(图3e)。和之前的低分辨率研究一致,cryo-EM展示IstB使用了它的N端结构域形成二聚物,二聚物能够通过ATP依赖的AAA+结构域互相作用寡聚形成蛤壳型十聚物(图3e,f)。在IstB十聚物中,已知8个核苷酸结合位点采用了典型的AAA+ ATPase构象,典型特征是其中一个单体的带正电的RF和相邻的亚基中的WA、WB典型基序相互作用(图3e,g)。EM图显示ATP在所有结合口袋中密度清晰(图3g)。这里的高分辨率图展现的十聚物中的AAA+结构域和在一种不可水解的类似物存在下分离的ATPase的晶体结构看到的不同(图3h)。IstB单体的旋转和倾斜导致了关键催化氨基酸的错位使IstB能维持自我抑制的构象。
IstB的首65个氨基酸是由3个小的α螺旋构成的,它们构成了二聚化分界面并且通过一个延长的螺旋延伸到AAA+结构域。许多带正电的氨基酸和靶DNA相互作用(图3f)。这些氨基酸和AAA+结构域的一个保守区域形成了每个IstB二聚物的内部腔。二聚物主要是通过非特异性作用和磷酸二酯骨架相联系的。IstB二聚物组装成十聚物产生了一个连续的U形的一个通道,它追踪了DNA的周期性(大约10.5bp)并使靶DNA弯曲大约180度(图3i)。
3. IS21 转座体重建
为了更好的理解IstB是如何促进IstA的招募与激活,他们重建了结合在转移链DNA上的IstA和IstB。IS21催化途径被认为和大多数转座系统相似。IstA转座酶首先配对并切割转座子末端产生两个游离的3’ OH基团(图4a),然后催化亲核攻击产生两个粘性末端,将供体分子整合到靶DNA,这个DNA产物称为STC。在体外,当只和分离的转座子右末端孵育,相比于与左端和右端相同摩尔量混合物孵育,IstA展现出相似的活性和3D结构。因此,为了减少结构的不对称性,作者做出了一个130bp长的DNA供体分子,它的末端包括R1和R2 重复序列(图4b和图2)。对于靶DNA来说,由于IS21没有很强的特异性,他们用了IS21首选的插入序列。因为很多IS21家族成员在转座之后产生5bp重复序列,因此插入位点相隔为5bp(图4b)。然后用凝胶层析和负染色EM优化缓冲液条件、蛋白质浓度和蛋白质/DNA比例来最大化转座体的形成。初步分析用野生型蛋白组装的样品的复合物是不稳定的,他们因此用IstB E167Q突变体来形成一个看起来和用野生型蛋白相同的更稳定的复合物。Cryo-EM结构显示IS21全转座体是由一个IstA四聚体和两个IstB十聚物组成的(图4c)。
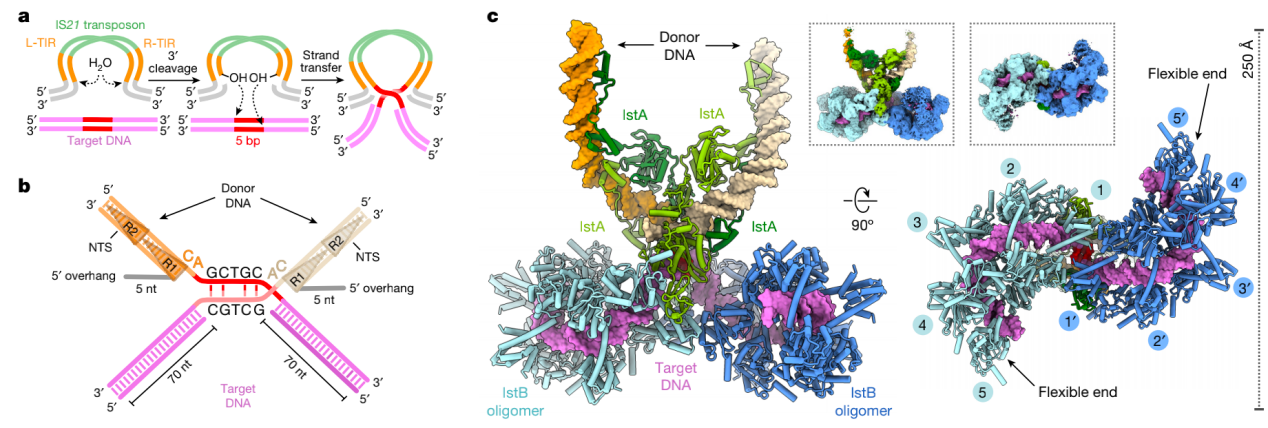
图4 IstA-IstB STC结构
4. IstB捕获S型靶DNA
两个IstB十聚物在转座酶的存在下能够二聚化。值得注意的是,它们不组装成一个连续的丝,而是以头-头的结构互相作用(标记为1和1’)(图4c)。每个IstB寡聚物的每个最内二聚体的N端结构域与位于相对十聚体的近端AAA+结构域的α螺旋对接(图5a)。有几个氨基酸似乎参与了互相作用,包括Arg84,它与第一个IstB二聚体的两个对称的Tyr35相结合(图5a)。这些氨基酸的突变在整合反应中扰乱IstB诱导的IstA催化的DNA整合(图5b)。这证实了它们结构上的重要性。
IS21转座体cryo-EM的重建展现IstB紧紧跟着双链DNA(大约每一IstB二聚物一个DNA弯)来维持为无IstA的复合物描述的总体构象和核酸接触。然而,两个IstB十聚物之间的互相作用也诱导了DNA在它们交点处急剧变形以产生了一个总体上的拐折的S形构象(图5c)。之前有报道表明易于拐折的DNA序列可以作为IS21和其他转座子家族比如IS3的转座热点区域。因此,IstB十聚物交点处的DNA急剧转弯作为靶DNA和被IstA转座酶带到这个复合物的供体DNA之间的接触点 (图5c)。
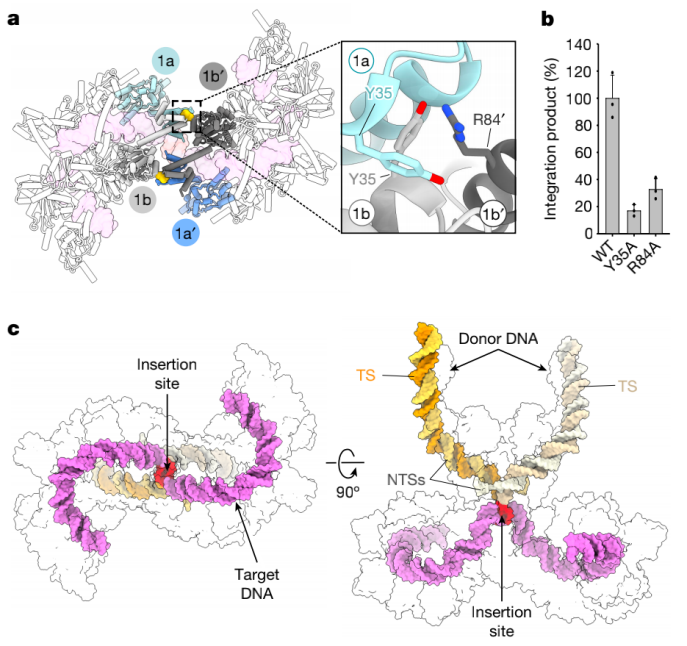
图5 两个IstB寡聚物之间的特异作用和STC中的DNA构象
5. IstA β-barrel 促进ATP的水解
全转座体结构不仅展示出IstB十聚物之间的未被预料的相互作用,它展现出IstB通过几个接触区域和IstA相互作用(图6a)。IstB的1a和1a’单体的AAA+亚基和转座酶的催化单体相互作用(图6a)。对IstA来说,这个识别是通过灵活地连在转座酶DDE结构域上的C端β-barrel进行的。这些元素对接到一个由IstB的N端二聚化和IstB的C端ATPase形成的外部的深缝隙(图6b)。IstA的Tyr343和Arg345的突变能够严重减弱转座酶激活IstB ATPase活性和被IstB激活促进DNA整合的能力(图6c,d)。
IstA的DDE区域也和IstB的1a和1a’ 的AAA+结构相互作用 (图4a,b,e)。放大看IstB活性位点显示与1a和1a'相连的核苷酸的密度和与ATP相连的IstB二聚体活性位点的不同。因此他们除去了转座酶和AAA+寡聚物中灵活的部分并且聚焦精细化全转座体核心。结果显示重建的3.2 Å的与IstA结合的IstB的活性位点的密度和ADP最一致(图6e)。
除此之外,在IstA的DDE区域的一个螺旋(205-214AA)和IstB的核苷酸结合口袋之间有大量的互相作用(图6e)。IstA这些位点的突变比如E209A和Y213A能减弱整合活性(图6d)。这些作用看起来能够改变IstB活性位点的构象。
值得注意的是IstB的Tyr170能够与其sensor I 氨基酸Asn199相互作用,当IstA结合的时候Tyr170改变了构象(图6e)。之前有提议IstB的Tyr170能够作为一个开关来控制IstB的ATPase活性。与这个提议一致,Y170A突变体维持整合活性但是减少了ATPase活性(图6c,d)。这表明了突变把ATP水解和整合反应分离开了。除此外,IstB中包含sensor II 氨基酸Arg237的α螺旋当IstA结合的时候转离活性位点,构象是通常在ADP结合的AAA+活性位点看到的脱离的结构(图6e)。总的来说,这些结果表明和转座酶相互作用的IstB单体采用了水解后的构象(图6e)。
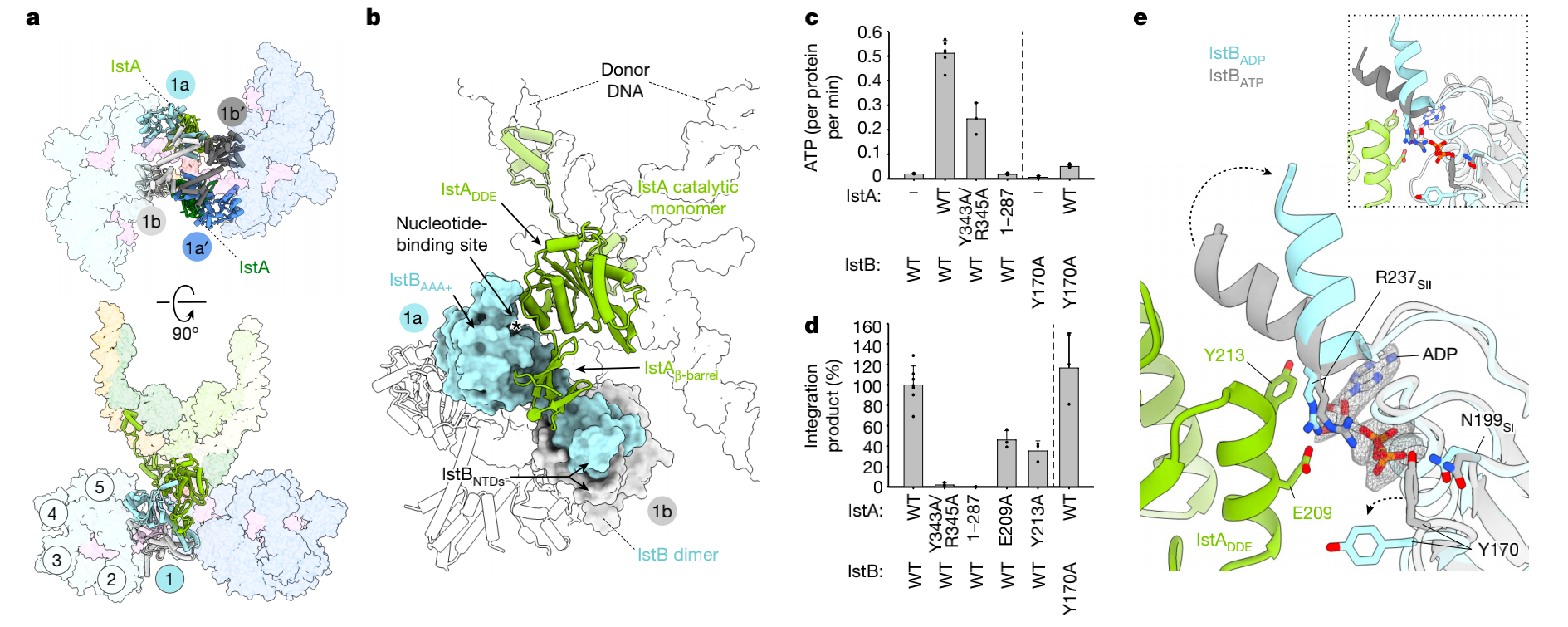
图6 IstA的C端结构域与IstB的相互作用对ATP的水解和DNA整合是重要的
6. IstB激活IstA转座酶
当IstB存在的时候,转座酶与靶DNA建立了新的相互作用,这包括了DDE结构域的氨基酸如Lys126, Asn188, Lys190 和Tyr 224,它们在上方的单体是暴露于溶剂的(图7a)。这些氨基酸的突变减少了整合活性,这支持了观察到的和靶DNA的接触的重要性(图7b)。他们进一步用无细胞反应检测IstA和靶DNA和在STC中的IstB建立的相互作用的生理功能。
IstA和IstB的相互作用也改变了没有IstB状态的IstA四聚体的结构。尤其是在IstA单体的整合位点近端的β-barrels和DDE与IstB ATPase之间形成的新的特异性作用诱导IstA催化亚基一个大规模的72度旋转(图5c)。这个构象的改变能够帮助转座酶的催化氨基酸重新定位来进行转座反应。它也诱导了转座酶上部的单体像剪刀一样张开,破坏在IstB结合之前形成的蛋白蛋白间相互作用,因此创建了一个高度扩展的构象,解开了由IstA稳定的转座前的切割的供体复合物中的供体DNA超螺旋(图7e)。
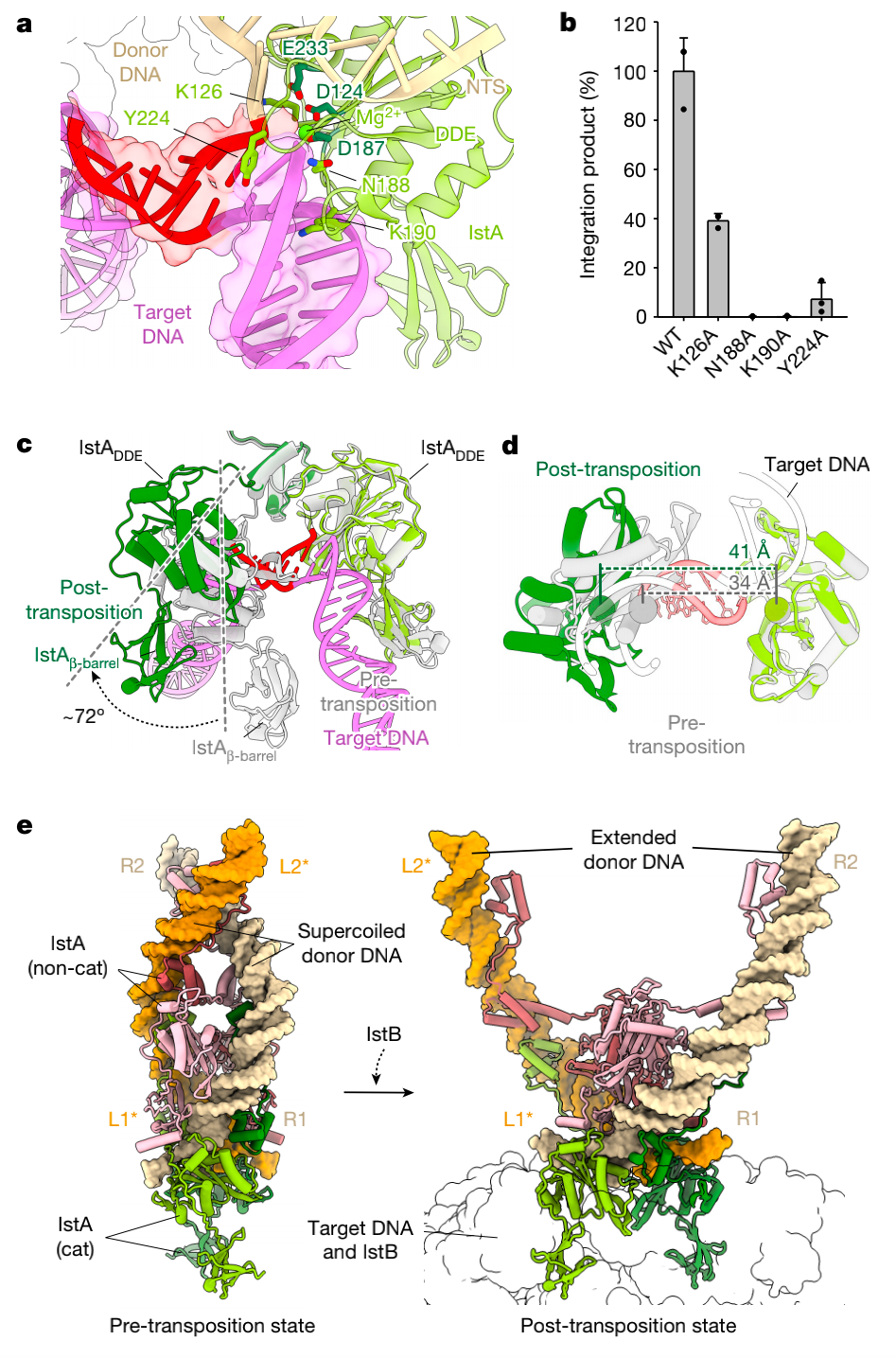
图7 IstA和IstB与靶DNA的互相作用诱导了转座酶大幅构象变化
•
✦
研究讨论
✦
•
重建的全长的IstB的十聚物的AAA+结构域的构象与分离的ATPase的X射线晶体结构显示有一点不同。由于X射线模型中的IstB缺乏调节的结构域和经典AAA+成员的相似性,X射线来源模型可能代表了理论上的活性位点。AAA+寡聚物的弯曲程度被改变来使关键的核苷酸结合的氨基酸错位并抑制ATPase活性。这种改变解释了ATP依赖的调节因子是如何作为分子开关在结合DNA后为催化作准备,然而维持一种自我抑制的构象直到它对应的转座酶结合上来。
IstB以U形的通道结合并弯曲靶DNA。值得注意的是,之前已经表明一些系统包括IS21的转座元件靶向S形的DNA。IstB的这种能力可能与局部DNA的灵活性联系,促进插入位点的查找和选择。与此一致,之前研究表明IS21可能更倾向整合到已经被表明易于适应弯曲构象的启动子附近区域。
值得注意的是,与IstB相关的IstA转座后状态和噬菌体中转座酶MuA的是相似的,作者因此推测MuA也发生相似的重组过程。
总结
研究意义
IstA对于诱导IstB ATPase 活性是必要的。IstB能够改变靶DNA的构象成S形,IstB与IstA相互作用并改变IstA的构象,从而激活IstA调控转座反应。这个研究阐述了转座反应是如何被ATP依赖的调控因子调控的。
参考文献
[1] de la Gándara, Á., Spínola-Amilibia, M., Araújo-Bazán, L., Núñez-Ramírez, R., Berger, J.M., Arias-Palomo, E. (2024). Molecular basis for transposase activation by a dedicated AAA+ ATPase. Nature 630, 1003–1011. https://doi.org/10.1038/s41586-024-07550-6
END
文案 | Linsey
排版 | Linsey
审核 | Linsey
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
