

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
KRAS G12D是胰腺导管腺癌和结直肠癌中最流行的KRAS突变体亚型。现在已经有几个研究团队用不同的策略开发了KRAS G12D特异型抑制剂。但是这些方案都处于临床前和初步的临床评估阶段,KRAS G12D在临床上仍然不能被药物靶向,而且KRAS抑制剂面临的一个重要挑战是大多数患者对这些治疗没有反应。已经有研究发现西妥昔单抗能够提高靶向KRAS G12C治疗和KRAS G12D抑制剂MRTX1133的抗肿瘤效应。这些研究表明了发现KRAS G12D抑制剂的致敏靶点使用联合疗法来提高抗肿瘤效应的重要性。
研究目的
Aim
1. 评估KRAS G12D特异性抑制剂HRS-4642治疗肿瘤的临床前和临床效果。
2. 发现HRS-4642的致敏靶点并使用联合疗法来提高对HRS-4642的敏感性。
METHODS
•
✦
研究方法
✦
•
1 | 细胞活力是用CCK-8试剂盒检测的。 |
2 | 表面等离子体共振(SPR)被用来测定KRAS和HRS-4642之间的动力学和亲和力。 |
3 | LC/MS被用来检测血浆中释放的或是全部的HRS-4642或是肿瘤组织中的HRS-4642。 |
4 | Ras的活性是用RAS GTPase Chemi ELISA Kit检测的。将细胞提取物加到GST-RAF-RBD涂层板,轻度振荡平衡一小时,用洗涤缓冲液洗三次,加入抗RAS抗体,用洗涤缓冲液洗三次,加入HRP二抗,用洗涤缓冲液洗四次,加入化学发光溶液后用光度计读数。 |
5 | 全基因组CRISPR-Cas9敲除基因的筛选被用来分析HRS-4642的致敏靶点。 |
6 | 流式细胞术被用来分析特定细胞比例的变化。 |
7 | 基于数据独立采集质谱的蛋白组学分析被用来发现蛋白和分析蛋白水平变化。为了发现潜在的协同作用机制进行GSEA分析。 |
FINDINGS
•
✦
研究发现
✦
•
1. HRAS-4642是一种靶向KRAS G12D的抑制剂
靶向治疗KRAS G12C的药物已经上市,但KRAS G12D仍然缺乏可行的治疗替代品。为了解决这个问题,作者开发了一种强效的高选择性的靶向KRAS G12D的新型的非共价抑制剂HRS-4642(图1A)。
首先作者想要评估HRS-4642与KRAS G12D的动力学和亲和力。SPR实验确认了HRS-4642能够结合KRAS G12D,且KD值比HRS-4642与KRAS G12C和KRAS WT的都小(图1B)。由KRAS/SOS1 AlphaScreen结合实验显示,HRS-4642能够选择性抑制GDP结合的KRAS G12D与SOS1的结合,其半抑制浓度比SOS1与KRAS WT的小(图1C)。活化的RAS检测显示与PC9 KRAS WT相比,HRS-4642可以选择性抑制AsPC-1 KRAS G12D活性(图1D)。由KRAS/RAF1 HTRF结合实验显示,HRS-4642能够选择性抑制GTP结合的KRAS G12D与RAF1的结合,其半抑制浓度比RAF1与KRAS WT的小(图1E)。
作者由蛋白免疫印迹(WB)显示高剂量HRS-4642能抑制携带KRAS G12D突变的人类结直肠癌细胞系GP2d中的p-MEK和p-ERK的水平(图1FG)。细胞活力测试结果显示HRS-4642对KRAS G12D生长抑制具有选择性,表现为HRS-4642对于含有KRAS G12D人类癌细胞系的IC50(0.55 to 66.58 nM)比对于其他细胞系的IC50小(248.50 to >10,000 nM)(图IJ)。
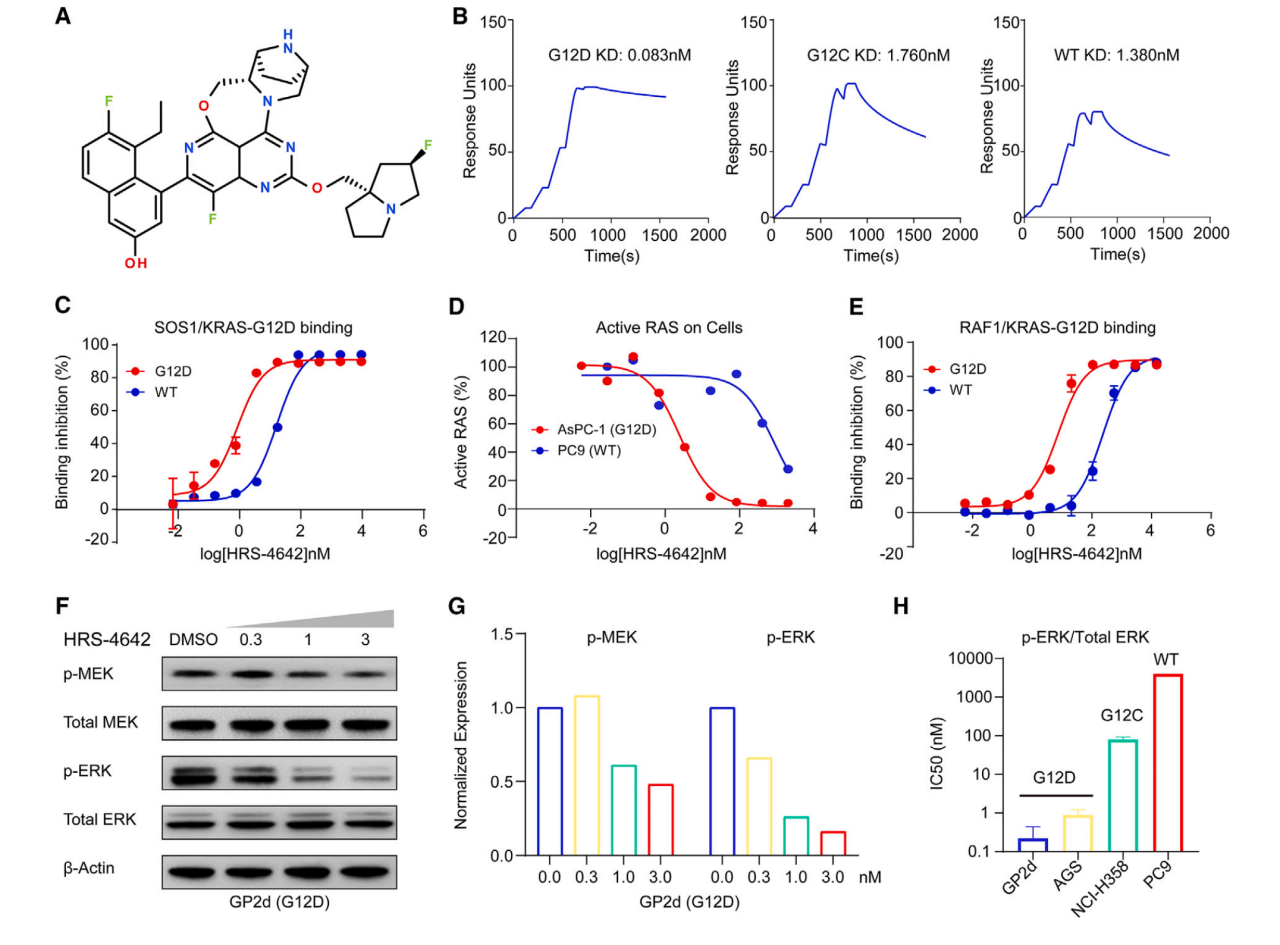
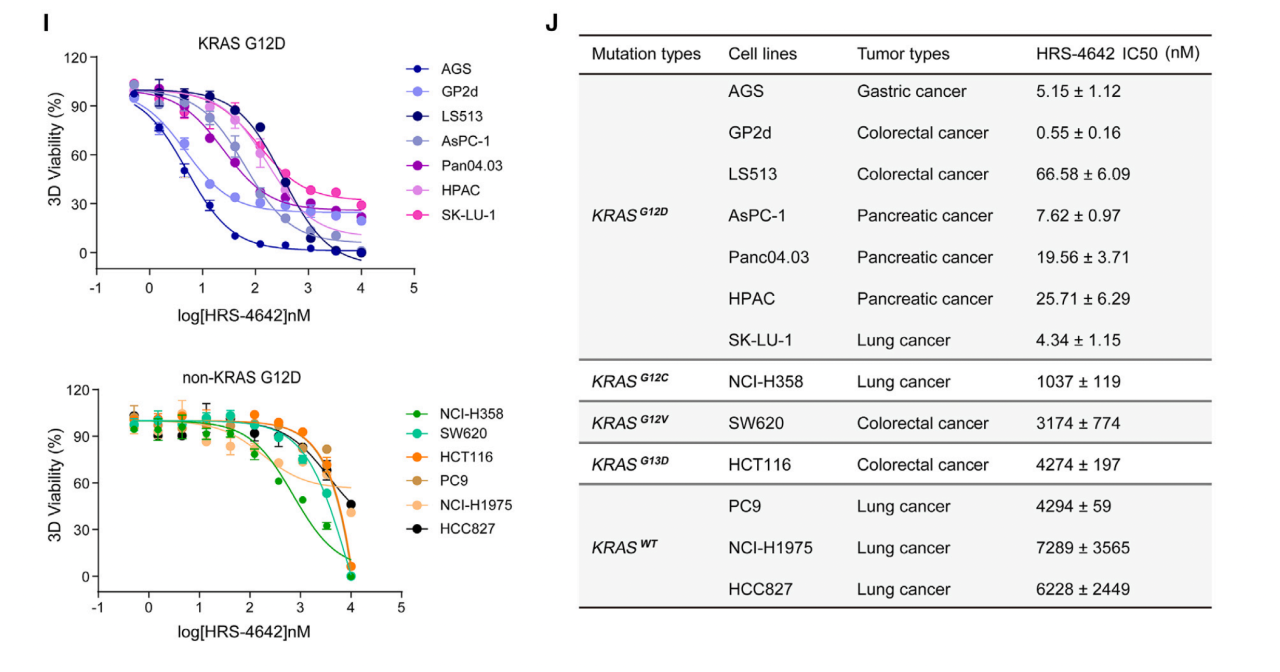
图1 HRS-4642在体外高效选择性抑制KRAS G12D
2. HRS-4642抑制KRAS G12D肿瘤生长
接下来作者想要评估HRS-4642的体内治疗效果,作者建立了携带KRAS G12D突变的人类肿瘤细胞AsPC-1或GP2d的BALB/c裸鼠的异种移植肿瘤模型。不同剂量HRS-4642脂质体制剂每周静脉注射一次。与对照组相比,HRS-4642处理的两个模型肿瘤生长都被显著抑制(图2AB)。此外,作者还建立了携带KRAS G12D突变的晚期肺腺癌患者样本的NSG小鼠的异种移植模型,发现与对照相比7.5或者15mpk HRS-4642处理消除了肿瘤的生长(图2C)。由小鼠的体重监测显示HRS-4642在治疗过程中的安全性(图2ABC)。
基于这些发现,作者继续用BALB/c裸鼠的GP2d异种移植肿瘤模型来进行药物代谢动力学和药效学标志物分析。3.75, 7.5或者15mpk HRS-4642 脂质体制剂注射一次后在0.5, 8, 24, 72, 120和168 h时间点监测药物在血浆(图2D)和肿瘤组织(图2E)中的浓度和p-ERK/ERK在肿瘤组织中的比值(图2F)。作者观察到HRS-4642剂量升高能提高它在血浆和肿瘤组织中的浓度(图2DE)。7.5或15mpk HRS-4642对p-ERK的抑制作用能达到一周(图2F)。作者还用免疫组织化学检测HRS-4642的抑制增殖和促进细胞凋亡的效果。注射单次15mpk HRS-4642 5天后检测AsPC-1的增殖标志物p-ERK和Ki67(图2GH)以及细胞凋亡标志物切割的PARP和Caspase3(图2IJ)。HE染色确认了HRS-4642的抗肿瘤作用(图2K)。
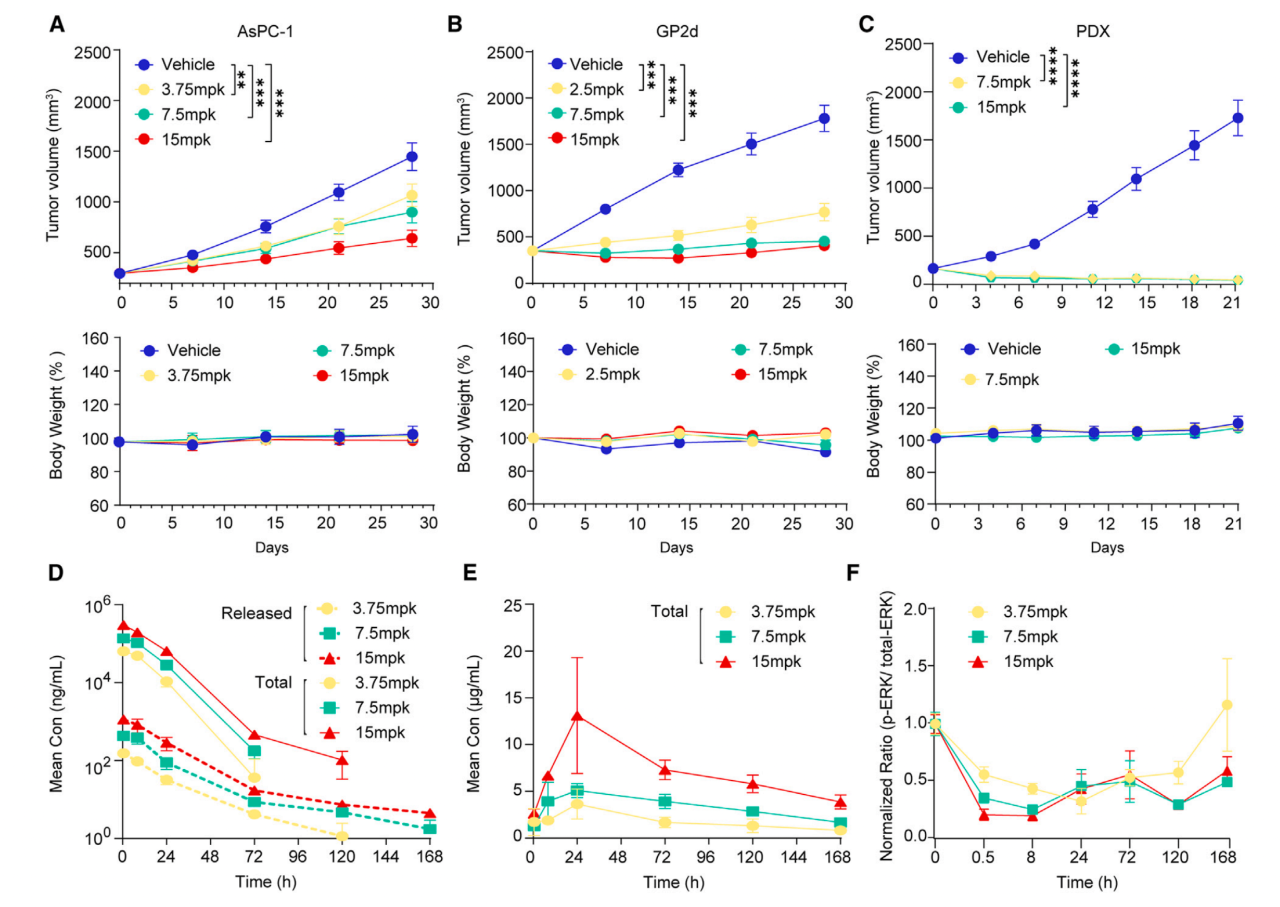
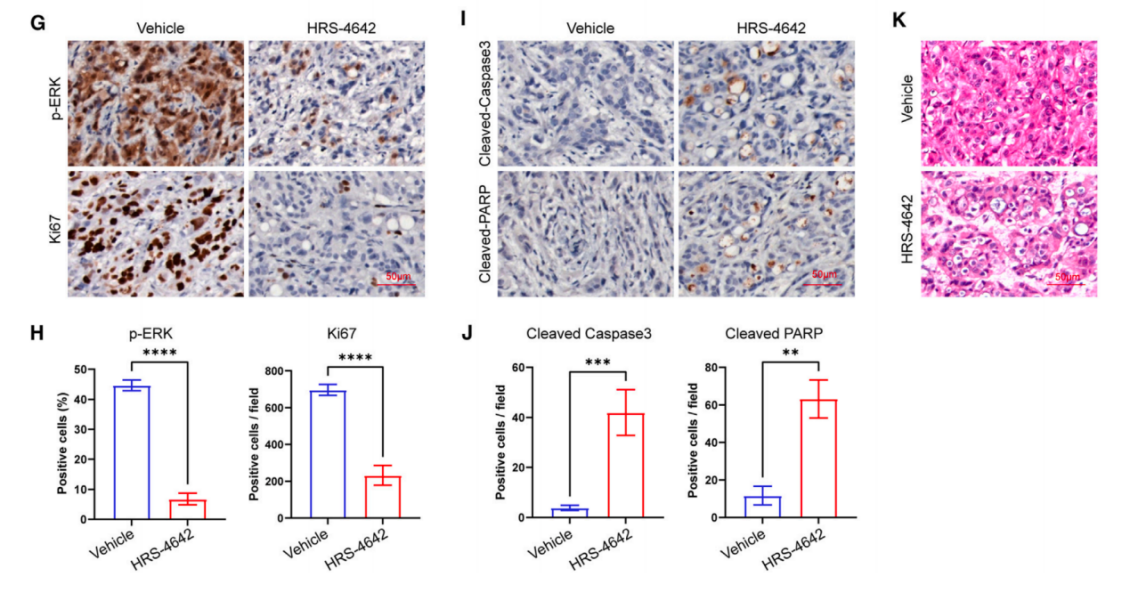
图2 HRS-4642抑制KRAS G12D突变肿瘤的生长
3. HRS-4642对携带KRAS G12D的
癌症患者的抗肿瘤效应
鉴于临床前研究展现出的强效力和选择性,他们开展了一个多中心开放标签的在带有KRAS G12D突变的晚期实体肿瘤病人中的一期临床试验(NCT05533463)。HRS-4642每周静脉注射一次,使用了剂量递增法。到2023年10月17日为止,他们从上海肺科医院招募了9个非小细胞癌患者。HRS-4642导致了2个病人客观的部分反应和7个病人疾病稳定。对于有反应的患者1,在6周治疗后,代表性病变消失了,效果持续了12周。胸腔积液消失了(图3B)。对于有反应的患者2,主要病变在治疗后的大小显著减少了31%。肺泡实变被显著缓解(图3B)。值得注意的是,那两个实现部分应答的患者之前已经在多种全身性治疗取得进展(图3C)。总之,结果显示这些患者对于HRS-4642是有反应的。
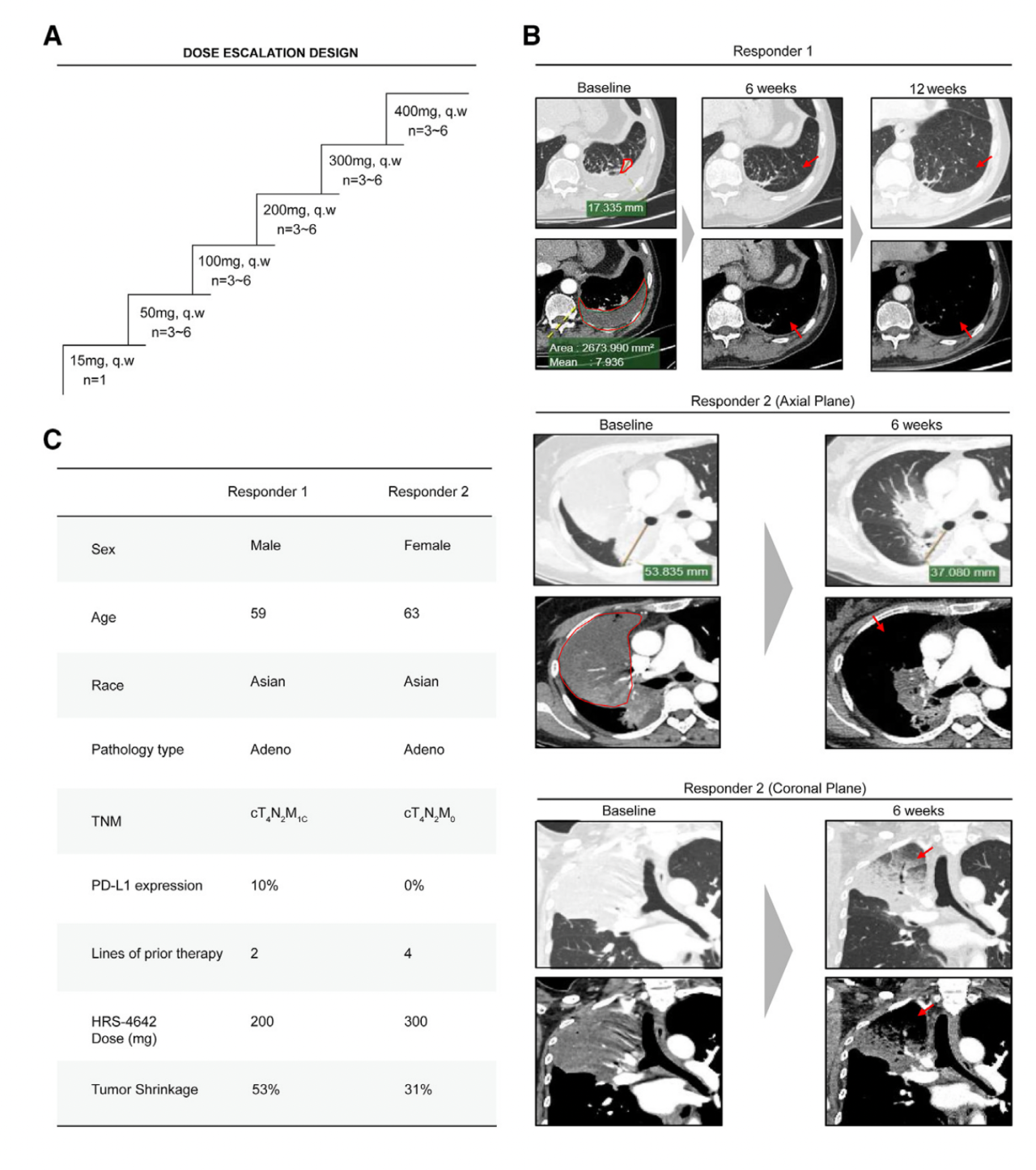
图3 HRS-4642在携带KRAS G12D突变肿瘤患者中的临床活性
4. CRISPR-Cas9筛选分析HRS-4642的
致敏和抵抗靶点
首先作者对HRS-4642在小鼠的多发性肺癌和胰腺癌细胞系中的效应和特异性也做了评估。CCK-8结果显示与无KRAS G12D的小鼠Lewis肺癌细胞相比,HRS-4642显著抑制携带KRAS G12D突变的小鼠癌细胞系的活力 (肺癌KP-1, KP-1-Clone 6, KP-3和胰腺癌FC1242,FC1242-Clone 5)(图4B)。
然后作者对稳定表达Cas9的KP-1-Clone 6和FC1242-Clone 5进行了全基因组CRISPR-Cas9筛选参与HRS-4642敏感性和抵抗性的基因和通路。作者发现FC1242中Sos2, Nras, Raf1, Pik3r1和Akt3 敲除能够增强对HRS-4642的敏感性(图4C)。KP-1中Sos2, Raf1, Cdk4, Cdk6, Aurka和Pik3ca敲除能够增强对HRS-4642的敏感性(图4D)。FC1242和KP-1细胞中有相同的减弱的18条通路参与了对HRS-4642的敏感性。其中有5条通路是和蛋白酶体有关的(图4F)。生存分析显示在肺腺癌患者中,较低表达的蛋白酶体特征与肺腺癌患者较长的无疾病生存期和总体生存期相关(原文附图3BE)。
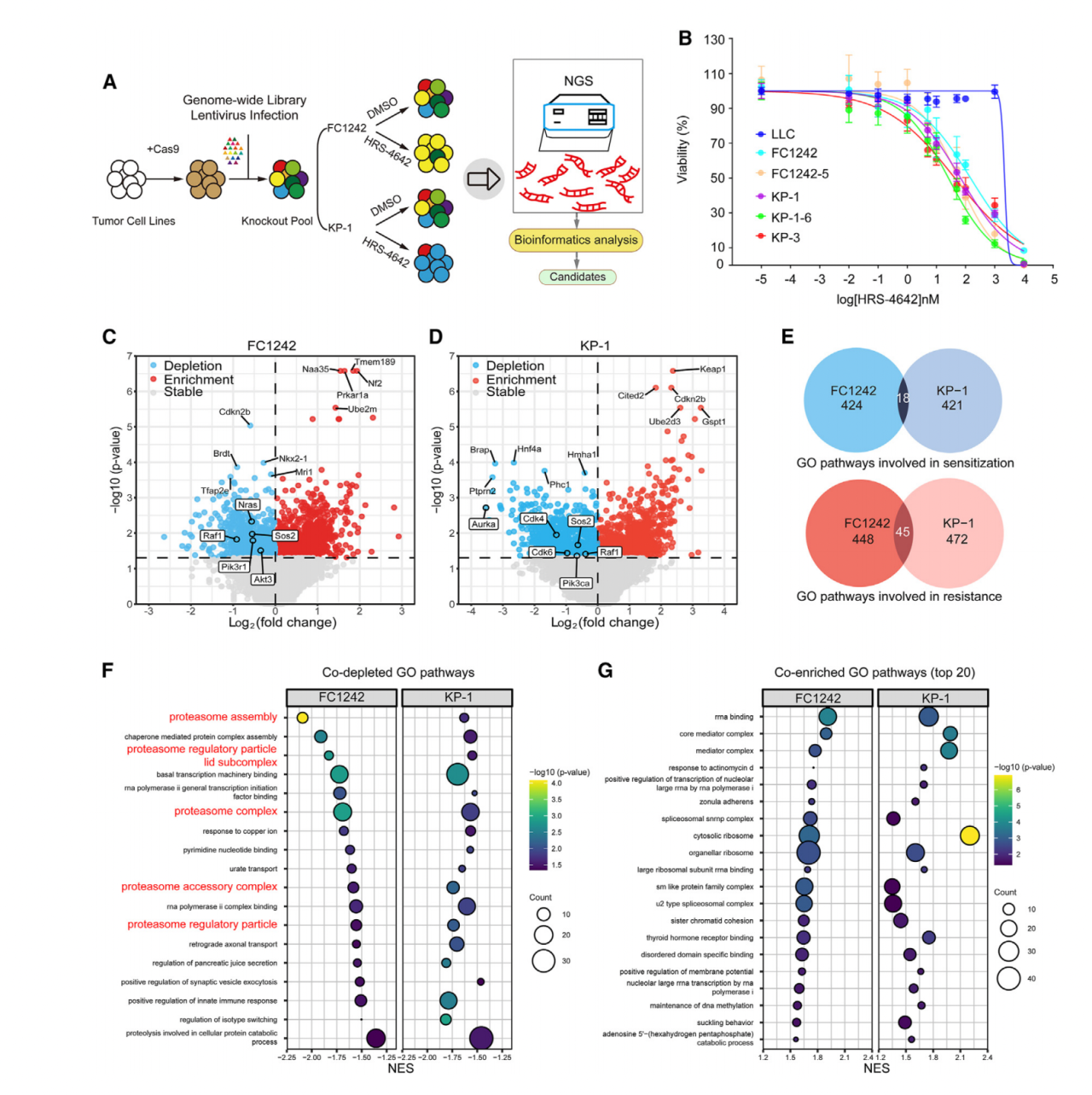
图4 全基因组CRISPR-Cas9筛选发现蛋白酶体抑制作为HRS-4642的协同治疗策略
5. 蛋白酶体抑制剂卡非佐米与HRS-4642联用的效应
泛素-蛋白酶体系统的失调会影响细胞循环调控,细胞生长,增殖,凋亡,DNA修复和其他与恶化相关的细胞信号通路。为了检验HRS-4642和蛋白酶体抑制剂卡非佐米是否存在协同效应,作者在FC1242, SK-LU-1, KP-1细胞系中进行了药物协同作用分析。作者进行了细胞活力测试和剂量-响应曲线分析,数据分析得到的协同分数显示,除了KP-1中的卡非佐米是相加作用,其他都是协同作用(图ABCD)。作者进行进一步的WB分析(p-ERK/ERK)(图5EFG)和蛋白酶体活力测试(图5H),认为结果确认了卡非佐米显著提高HRS-4642的体外治疗效应。
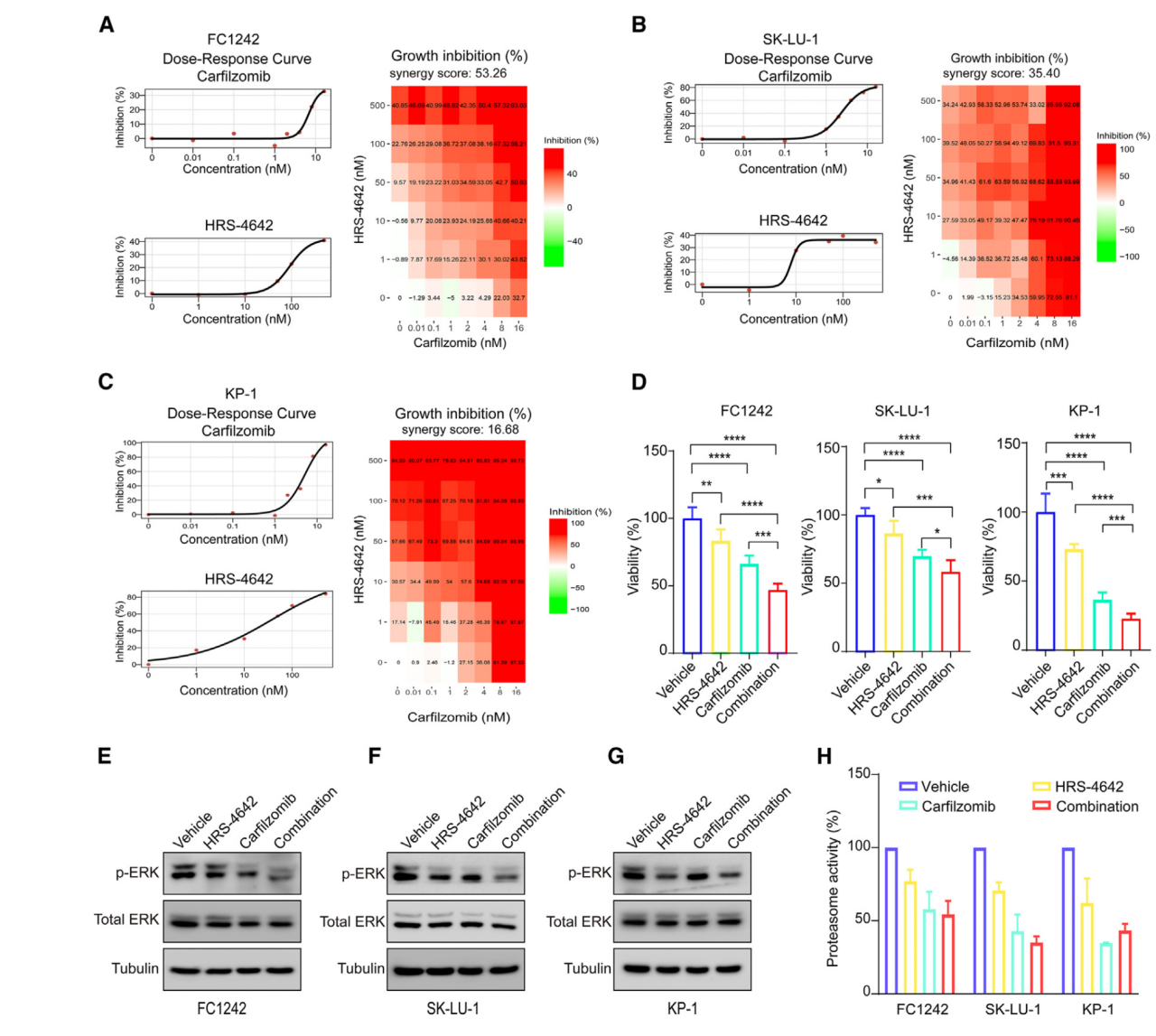
图5 蛋白酶体抑制剂卡非佐米在体外与HRS-4642协同作用
在体内,HRS-4642对于FC1242肿瘤生长没有作用,但是和卡非佐米共用能够抑制肿瘤生长且不影响小鼠体重(图6A)。与这个结果一致,HRS-4642和卡非佐米共用对于KP-1和AsPC-1的抑制作用比单独使用两个药物的效果好且不影响小鼠体重(图6BC)。作者还进行了HE染色,认为单一使用HRS-4642对肿瘤侵袭的抑制效果是剂量依赖的,与卡非佐米的共用增强了HRS-4642的抑制效果(图6D),表明HRS-4642的抗肿瘤效应可以被靶向蛋白酶体提高。
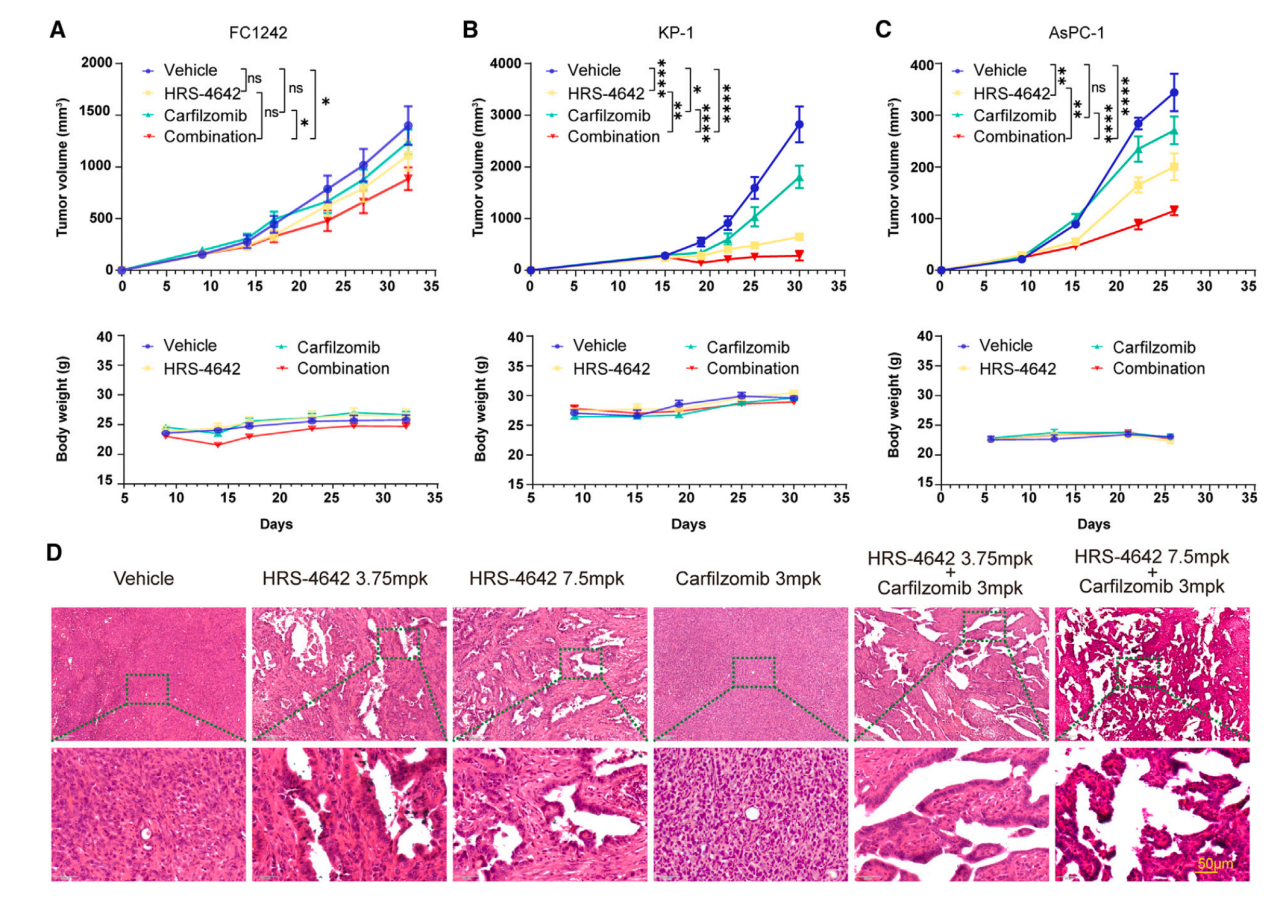
图6 蛋白酶抑制剂卡非佐米在体内增强HRS-4642的抗肿瘤效应
6.HRS-4642单一治疗
或者结合卡非佐米诱导抗肿瘤免疫
他们对皮下接种KP-1的C57BL/6小鼠肿瘤组织进行免疫分析检测。流式细胞分析显示接受了HRS-4642或者两种药物共用组的CD45+在活细胞中的比例和CD4+或 CD8+ 在CD45+细胞中的比例显示显著增长(图6FGI)。接受了HRS-4642或者两种药物共用的效应T细胞 CD44+ CD62L- 在CD4+或者CD8+的比例也显著增加(图6HJ)。除此之外,两种药物共用组的功能性分子IFN gamma+和GZMB+在CD8+的比例显著增加,只接受了HRS-4642组的并没有显著变化(图6KL)。总之,HRS-4642尤其结合卡非佐米可能能改造肿瘤微环境促进有抗肿瘤性质的免疫细胞的浸润和激活。
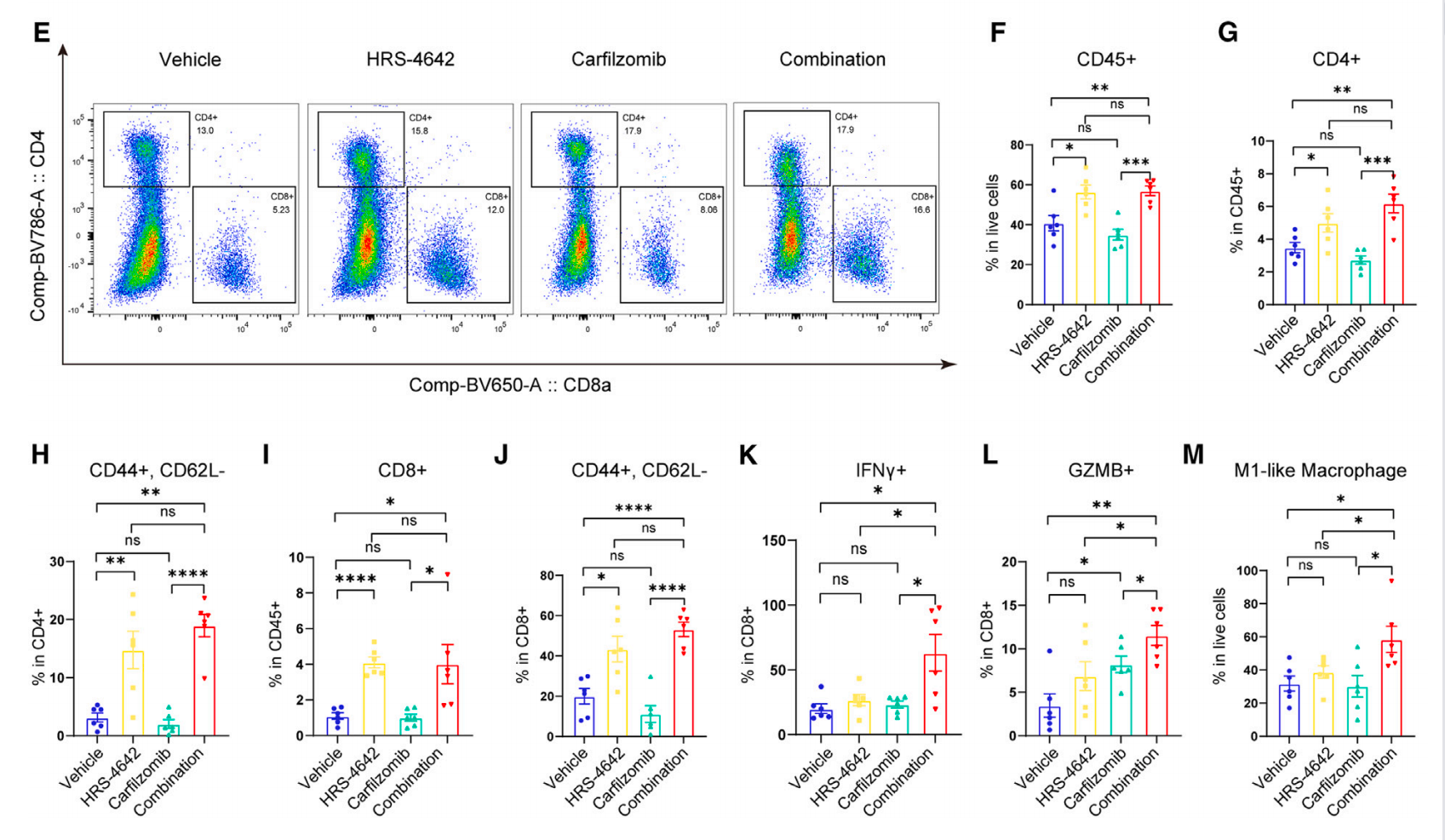
图6 HRS-4642和卡非佐米协同作用改变肿瘤免疫微环境
7. 卡非佐米结合HRS-4642通过抑制Notch4信号通路
和增强干扰素alpha应答发挥作用
为了发现卡非佐米和HRS-4642的协同作用机制,作者用RNA测序和基于数据独立采集质谱技术的蛋白组学对用药物处理或未处理的KP-1细胞分析发生变化的通路。作者由富集分析发现了只在两个药物共用组的RNA和蛋白质水平都显著变化的77条通路(图7A)。Notch4信号通路负调控显示显著上调(图7B)。作者进一步用WB确认Notch4信号通路在协同治疗组的下调,并伴随细胞凋亡增强(图7C)。作者还发现了干扰素alpha反应在单一治疗和共用组都显著上调,且两个药物共用增强了单一药物治疗的效果(图7EFG)。RT-PCR证明了干扰素alpha应答通路中的Ifi30, Irf7, Ddx60, Trim12a, II7表达变化一致上调(图7H-L)。Cxcl16被报道与T细胞浸润、激活和存活相关,它在单一治疗和共用组都显著上调(图7M)。
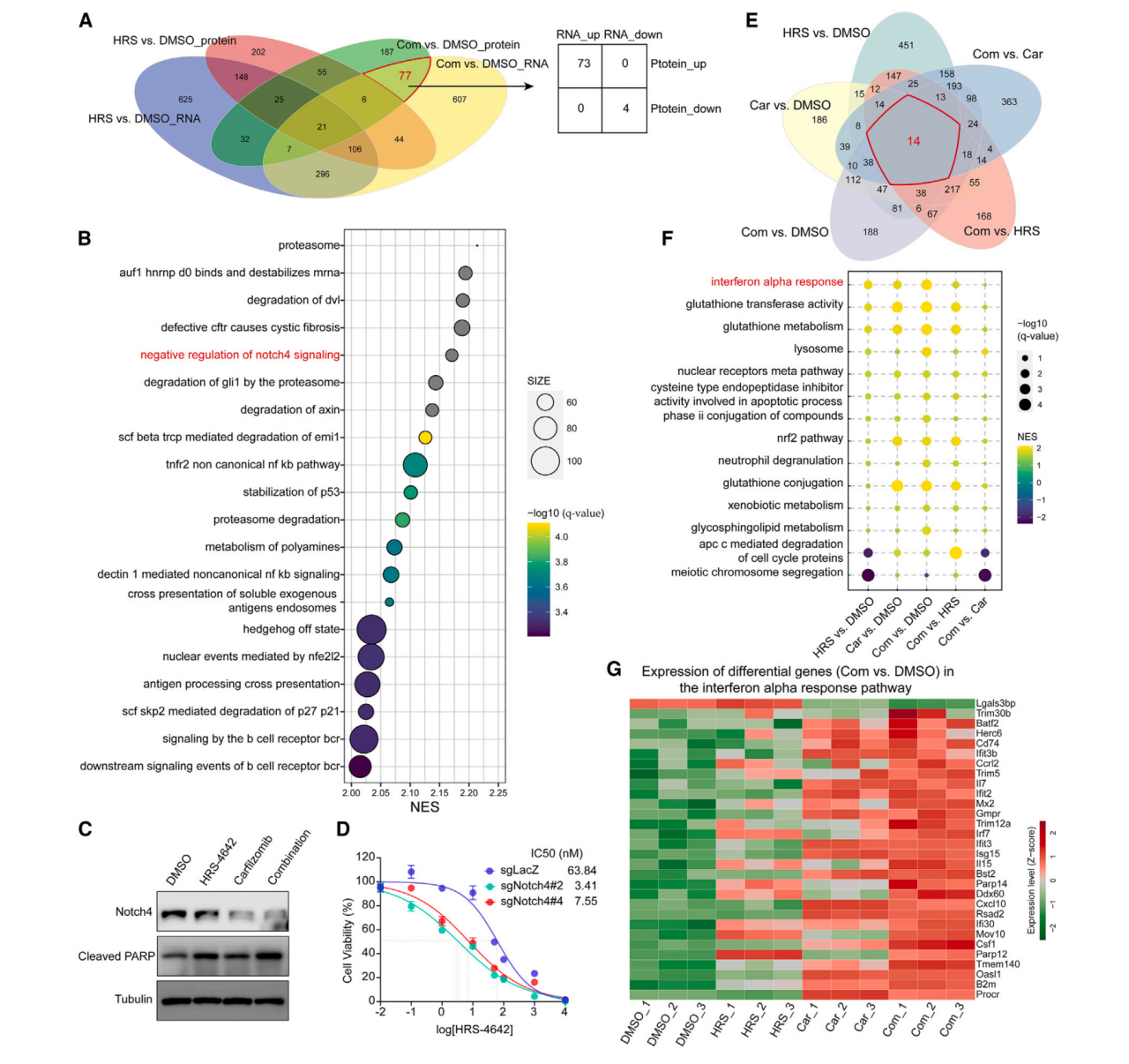
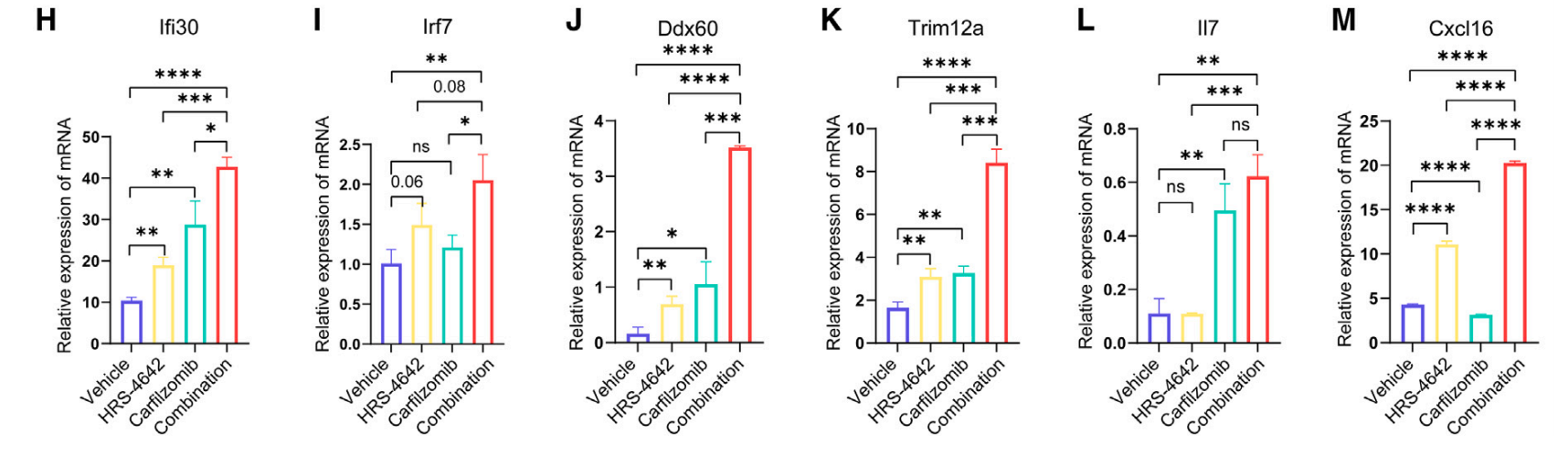
图7 卡非佐米通过抑制Notch4信号通路和促进干扰素alpha通路与HRS-4642协同作用
•
✦
研究讨论
✦
•
KRAS G12D是促进癌症型突变,在这个研究中作者开发了一种具有高度亲和力和选择性的抑制剂HRS-4642,它在体外和体内都展现出对KRAS G12D突变肿瘤的强的效应。但是由于KRAS G12D在不同情境下的促进癌症的作用不同,靶向治疗的效果可能不同。作者因此寻找潜在的能够提高HRS-4642抗肿瘤作用的基因或者通路。他们首次发现蛋白酶体抑制剂卡非佐米结合HRS-4642使用能够提高它的敏感性,这支持了蛋白酶体通路在KRAS突变的癌症中发挥了重要作用。值得注意的是,KRAS不仅影响肿瘤增殖也影响免疫微环境。作者发现HRS-4642或卡非佐米结合使用能够显著促进CD4和CD8 T细胞的浸润。HRS-4642和卡非佐米结合使用可能对治疗携带KRAS G12D的实体瘤有效果。
本研究的局限性是临床试验中非小细胞癌患者病例数量有限。9个患者中有2个对药物治疗有反应。
总结
研究意义
HRS-4642能够在体外结合KRAS G12D,在体外和体内抑制KRAS G12D突变的肿瘤生长,它还对KRAS G12D癌症患者有抗肿瘤效果。蛋白酶体抑制剂卡非佐米能够增强HRS-4642在体外和体内的抗肿瘤效应。HRS-4642单一治疗或者与卡非佐米联合使用能够改变肿瘤微环境。Notch4信号通路的下调和干扰素alpha应答的上调可能导致两个药物的协同作用。
参考文献
[1] Zhou, C., Li, C., Luo, L., Li, X., Jia, K., He, N., Mao, S., Wang, W., Shao, C., Liu, X., et al. (2024). Anti-tumor efficacy of HRS-4642 and its potential combination with proteasome inhibition in KRAS G12D-mutant cancer. Cancer Cell. 42, 1286-1300. doi: 10.1016/j.ccell.2024.06.001.
END
文案 | 林夕
排版 | 林夕
审核 | 林夕
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
