

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
肿瘤的早期诊断和治疗对于提高患者生存率和生活质量至关重要。荧光成像作为一种高灵敏度、高选择性、非侵入性的成像技术,在肿瘤诊断和治疗中展现出巨大的潜力。
光动力疗法(PDT)和化学动力疗法(CDT)作为新兴的肿瘤治疗方法,具有低毒性、低耐药性等优点,但各自也存在局限性。PDT主要受缺氧环境和光穿透深度限制。CDT的反应效率和靶向性仍然需要进一步研究。
近日,香港科技大学唐本忠院士团队开发的TPE-APP探针巧妙地结合了光动力疗法(PDT)和化学动力疗法(CDT)的优势,克服了它们各自的局限性,实现了高效、精准的肿瘤治疗。
克服缺氧环境限制:TPE-APP探针在ALP的催化下,可以生成具有强光动力活性的TPE-DMA聚集体,即使在没有氧气的情况下,TPE-DMA聚集体也能通过激发态能量转移产生ROS,实现PDT。
克服光穿透深度限制:TPE-APP探针通过靶向肿瘤细胞,在肿瘤细胞内部产生ROS,从而实现深层肿瘤的治疗。
克服反应效率有限问题: PE-APP探针在ALP酶的催化下,可以生成具有强化学动力活性的醌甲烷中间体,该中间体可以与肿瘤组织中的还原物质发生反应,产生高毒性的ROS,从而实现高效的CDT。
克服靶向性差问题:TPE-APP探针通过靶向肿瘤细胞中的碱性磷酸酶(ALP酶),实现肿瘤细胞的选择性杀伤,从而避免对正常组织的损伤。
研究亮点
highlight
TPE-APP探针的优势:
高效ROS生成: TPE-APP探针在ALP的催化下,可以同时生成具有强光动力活性的TPE-DMA聚集体和具有强化学动力活性的醌甲烷中间体,从而实现高效的ROS生成。(图1)
精准靶向肿瘤细胞: TPE-APP探针通过靶向肿瘤细胞中的ALP,实现肿瘤细胞的选择性杀伤,从而避免对正常组织的损伤。
成像引导治疗: TPE-APP探针的荧光信号可以用于肿瘤成像,从而实现成像引导的治疗。
CONTENTS
•
✦
研究方法
✦
•
1 | 光物理性质和ROS生成能力表征 ALP响应能力评估;ALP选择性测试;HPLC分析验证识别机制;ROS生成能力评估;光动力活性评估;化学动力活性评估。 |
2 | 细胞实验 细胞成像: 使用激光共聚焦显微镜观察TPE-APP探针在细胞内的分布和荧光信号,评估其对肿瘤细胞的特异性成像能力。 细胞毒性评估:使用MTT实验评估TPE-APP探针在黑暗条件下和光照条件下对肿瘤细胞的细胞毒性,评估其化疗和光动力活性。 细胞凋亡分析:使用Annexin V-FITC/PI染色和流式细胞术分析TPE-APP探针对肿瘤细胞的凋亡诱导作用。 细胞膜损伤评估:使用LDH检测试剂盒检测TPE-APP探针对细胞膜的损伤作用。 线粒体膜电位评估:使用JC-1探针检测TPE-APP探针对肿瘤细胞线粒体膜电位的影响。 |
3 | 体内实验 肿瘤模型建立:将HeLa细胞注射到裸鼠皮下,建立肿瘤模型。 体内肿瘤成像:使用活体成像系统观察TPE-APP探针在肿瘤组织中的荧光信号,评估其对肿瘤的特异性成像能力。 体内抗肿瘤治疗:将TPE-APP探针注射到肿瘤组织,并给予光照或黑暗处理,评估其对肿瘤生长的抑制作用。 组织学分析:使用H&E染色和TUNEL染色分析肿瘤组织的病理学变化,评估TPE-APP探针的抗肿瘤效果。 |
4 生物安全性评估 体重监测:监测裸鼠在TPE-APP探针处理后的体重变化,评估其毒性。 血液学分析:使用血细胞分析仪检测裸鼠在TPE-APP探针处理后的血常规指标,评估其对血液系统的影响。 血液生化分析:使用生化分析仪检测裸鼠在TPE-APP探针处理后的血液生化指标,评估其对肝脏和肾脏功能的影响。 病理学分析:使用H&E染色观察裸鼠在TPE-APP探针处理后的主要器官的病理学变化,评估其毒性。 溶血实验:使用溶血实验评估TPE-APP探针对红细胞的影响,评估其溶血毒性。
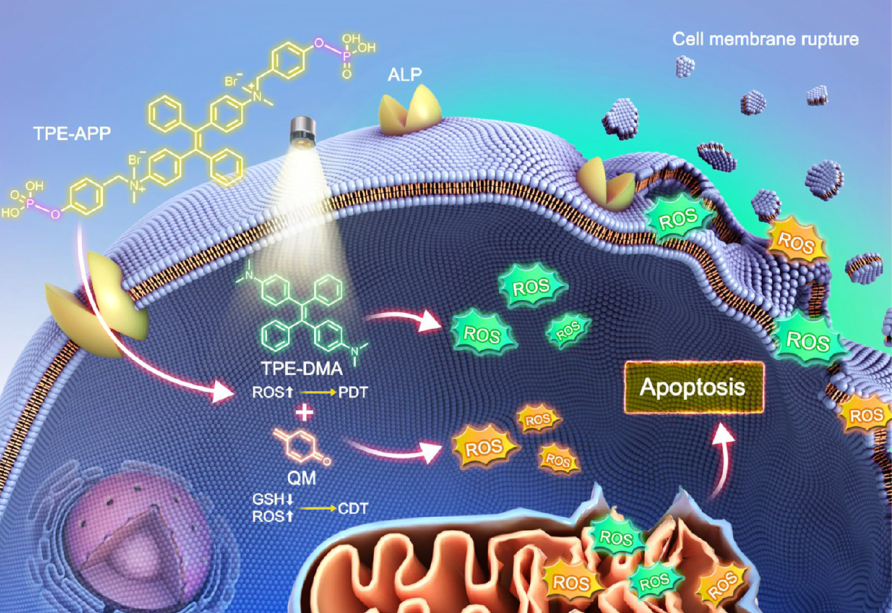
图1 荧光探针的设计策略
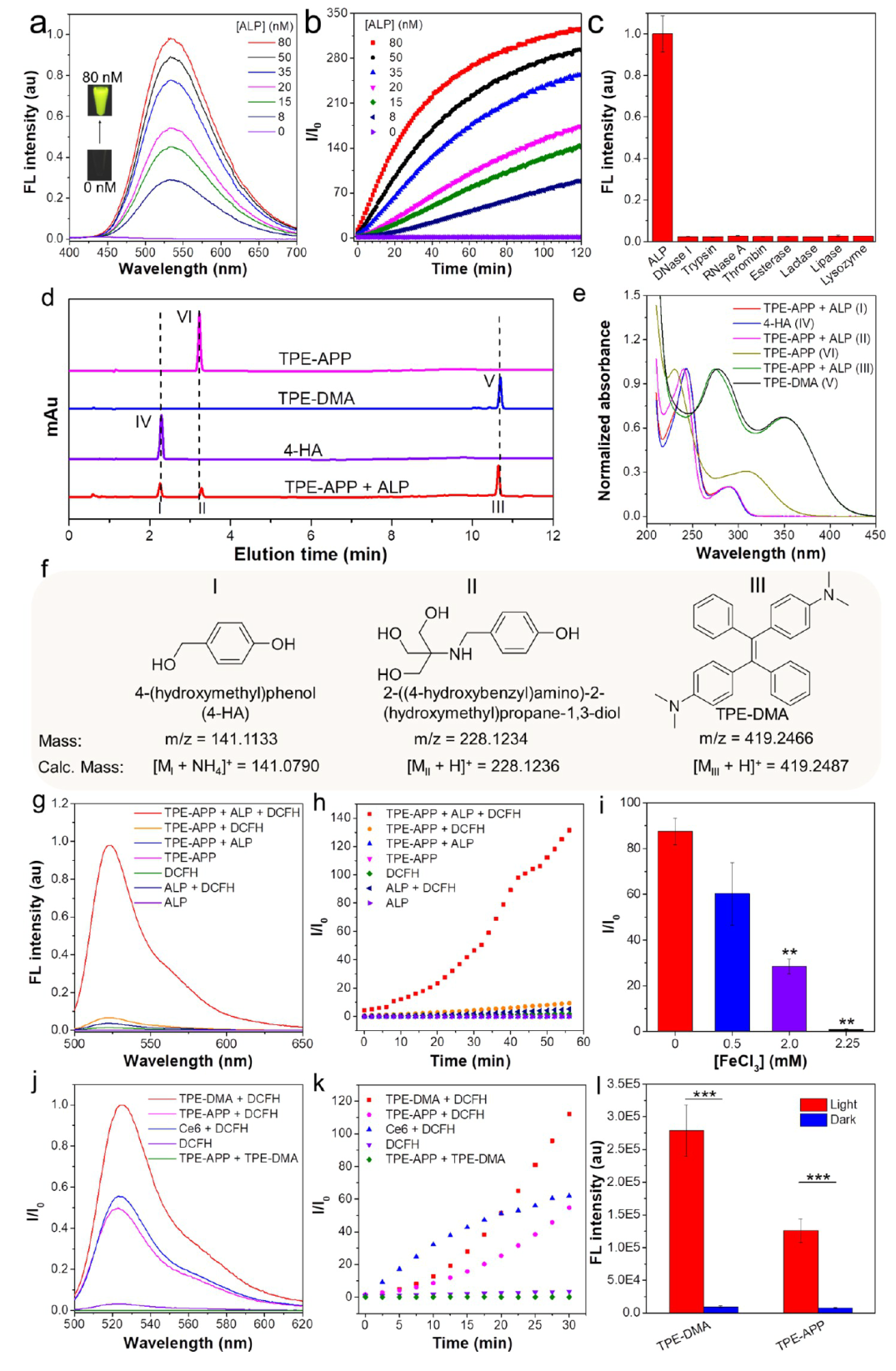
图2 探针的体外光谱响应结果和ROS生成能力表征
RESULTS
•
✦
研究结果
✦
•
基本信息描述
1. 探针具有优异的ALP响应表现和ROS生成能力 TPE-APP探针在ALP的催化下,可以发生水解反应,生成具有强发射的TPE-DMA聚集体和具有强化学动力和光动力活性的醌甲烷中间体。(图2) 2. 探针能够实现对肿瘤细胞的选择性成像 TPE-APP探针可以响应肿瘤细胞中异常表达的ALP生物标志物,在肿瘤细胞中选择性地生成强荧光发射的TPE-DMA聚集体,从而实现对肿瘤细胞的特异性成像。(图3) |
3. 探针具有良好的细胞杀伤能力 TPE-APP探针在黑暗条件下和光照条件下均表现出对肿瘤细胞的特异性、剂量依赖性细胞毒性,且光照条件下细胞毒性显著增强,表明TPE-APP探针可以通过PDT和CDT联合杀伤肿瘤细胞。(图4) 4. 探针能够实现体内肿瘤成像和联合治疗 TPE-APP探针可以实现对肿瘤的特异性成像,并且通过联合化疗和光动力疗法有效抑制肿瘤生长,且对正常组织无明显毒性。(图5) |
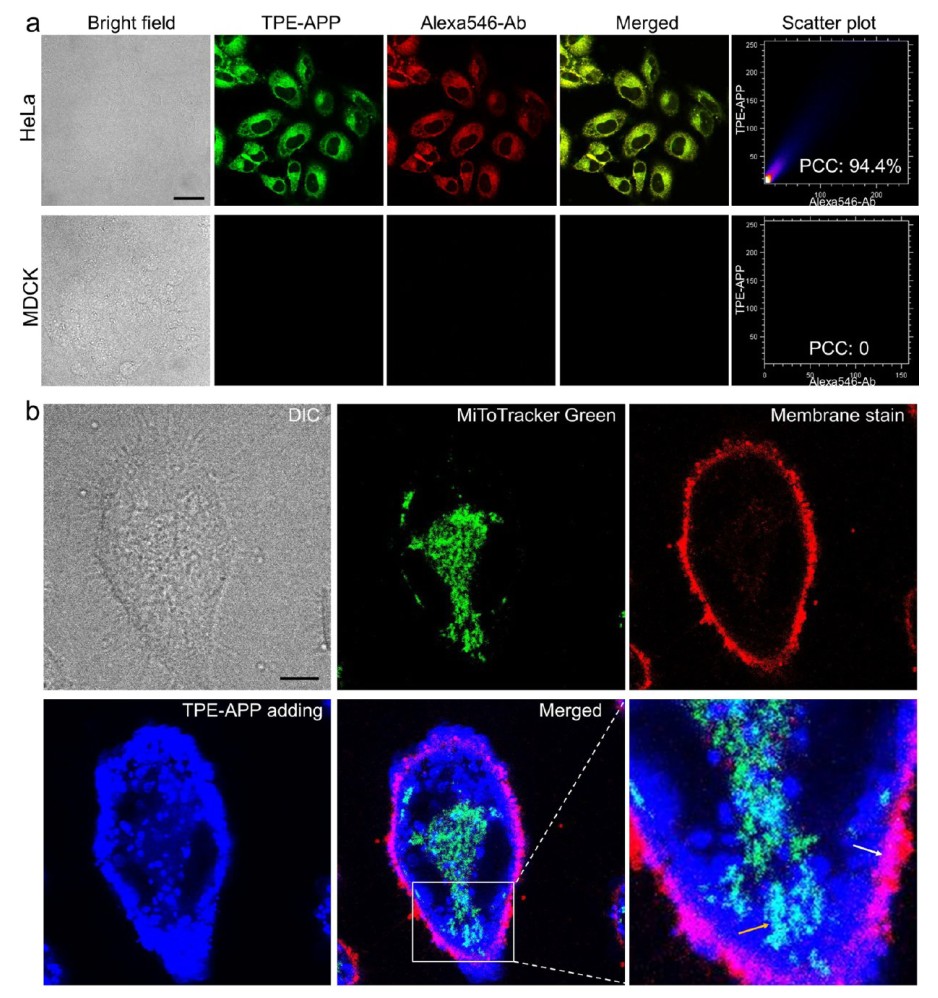
图3 探针对肿瘤细胞的特异性成像表现
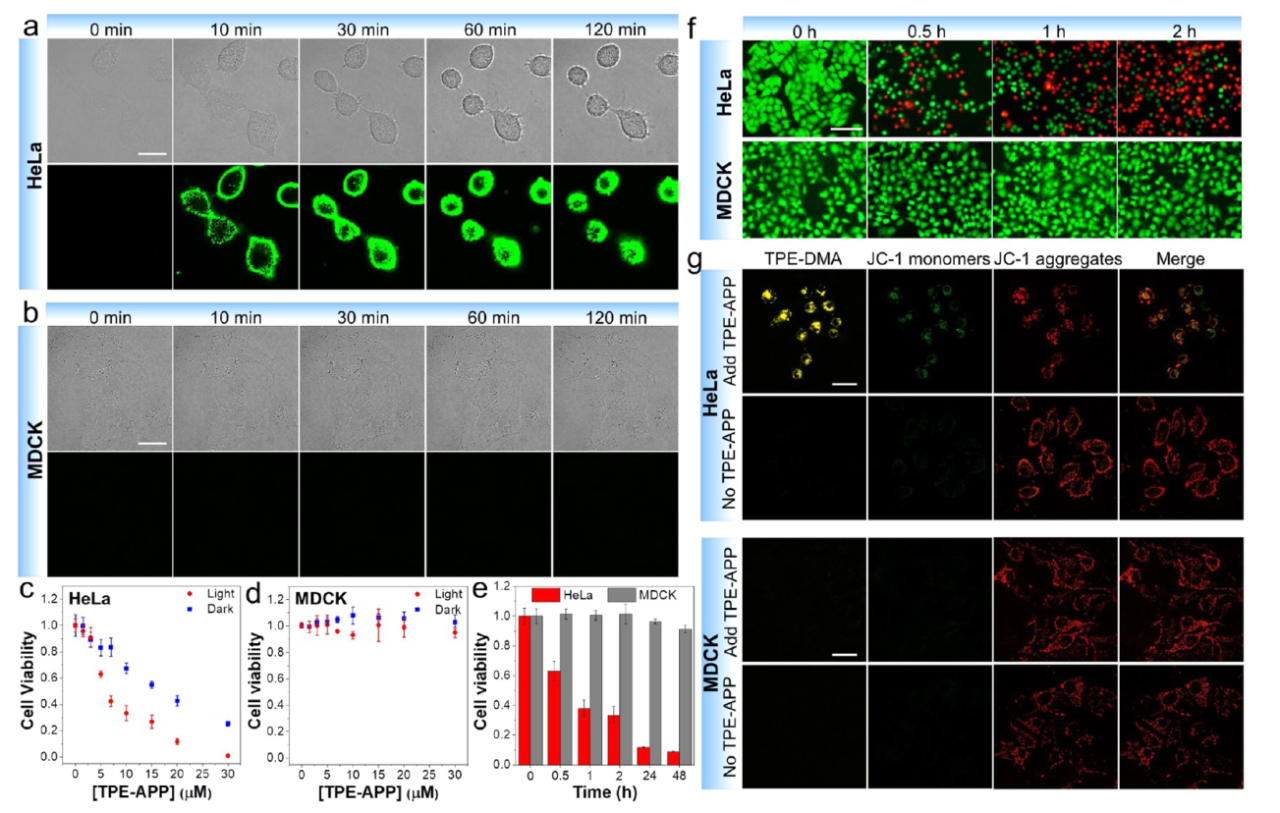
图4 探针对肿瘤细胞的特异性杀伤能力评估
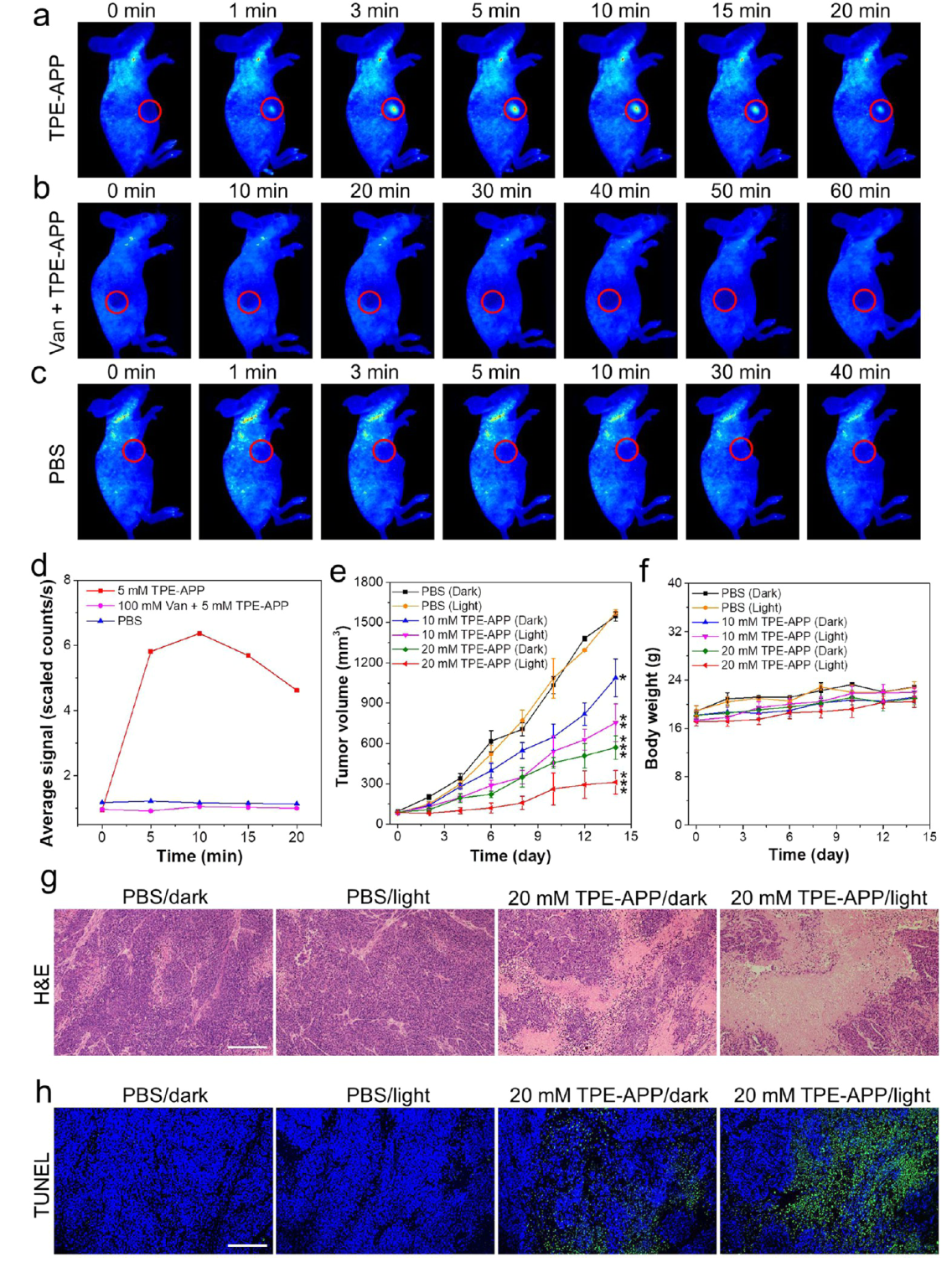
图5 探针在肿瘤小鼠中的成像表现以及联合治疗效果评估
DISCUSSION
•
✦
研究讨论
✦
•
研究局限性 本研究主要在体外和体内肿瘤模型中进行了实验,还需要进一步研究TPE-APP探针在临床应用中的安全性、有效性和可行性。 TPE-APP探针的靶向性和稳定性还需要进一步优化,以提高其在临床应用中的治疗效果。 |
总结
Summary

本研究开发了一种多功能AIE探针TPE-APP,该探针能够响应肿瘤细胞中异常表达的ALP生物标志物,在肿瘤细胞中选择性地生成强发射的AIE聚集体和具有强化学动力和光动力活性的醌甲烷中间体,从而实现成像引导的联合化疗和光动力疗法。体外和体内实验均证实了TPE-APP探针在肿瘤消融方面的优异性能。这项研究为精准的肿瘤诊断和治疗提供了一种有前景的策略,即通过设计多功能肿瘤特异性生物标志物响应探针来实现成像引导的联合化疗和光动力疗法。
参考文献
[1] Ling-Hong Xiong, Langyi Yang, Jiangtao Geng, Ben Zhong Tang, and Xuewen He, All-in-One Alkaline Phosphatase-Response Aggregation-Induced Emission Probe for Cancer Discriminative Imaging and CombinationalChemodynamic-Photodynamic Therapy,ACS Nano 2024, 18, 17837−17851.
PROFILE
唐本忠教授
香港中文大学(深圳)教授
理工学院院长
中国科学院院士
亚太材料科学院院士
发展中国家世界科学院院士
国际生物材料科学与工程学会联合会会士

唐本忠教授的主要研究领域包括:
聚集诱导发光 (AIE): 唐教授是AIE现象的发现者,并对其进行了深入研究,包括AIE分子的设计、合成、性质和应用等。
光功能材料: 致力于开发具有特定光物理和光化学性质的材料,用于光电器件、生物成像、光动力疗法等领域。
纳米材料: 研究纳米材料的合成、表征和应用,包括纳米药物、纳米传感器、纳米催化剂等。
生物成像: 开发新型荧光探针和成像技术,用于生物分子的检测、细胞成像、肿瘤成像等。
光动力疗法: 研究新型光敏剂和光动力疗法,用于肿瘤治疗。
目前已发表超过1500篇论文,其研究成果被引用超过11.3万次,H指数达到151。自2014年起,Clarivate Analytics将他列为化学和材料科学领域的高被引学者。他曾获得国家自然科学奖一等奖(2017年)、何梁何利基金会的科技进步奖(2017年)等多项荣誉。目前,他担任Wiley出版社出版的Aggregate期刊的主编。
END
文案 | 陆细刚
排版 | 陆细刚
审核 | 陆细刚
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
