

INTRODUCTION
•
✦
研究介绍
✦
•
研究背景
Background
1. GGT检测对于癌症早期诊断的重要性
癌症的早期诊断在临床肿瘤学中至关重要。即使是很小的癌症转移 (2 ~ 3 mm)都可能对人体健康构成致命威胁。然而,常用的正电子发射断层扫描和计算机断层扫描很难检测到直径小于1cm的肿瘤。γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)作为一种重要的癌症相关酶,在维持细胞氧化还原代谢稳态中起着至关重要的作用。它在各种癌细胞的细胞膜上高度表达,促进肿瘤发生、进展、和侵袭。因此,准确检测GGT可大大提高肿瘤诊断的效率。
2. 提高探针信背比至关重要
近年来,已经开发了多种可激活的荧光探针,用于肿瘤细胞和活体中GGT的检测和成像。然而,它们的实际临床应用仍然受到低信背比(SBR)的阻碍,这主要是由于生物背景荧光过强、探针本身荧光过强、荧光团在生物体系的亮度不理想造成的。
为了提高癌症的成像的信背比和精确性,来自香港中文大学和澳门大学的研究团队从上述三个方面进行针对性解决,最终开发出一例高信背比(1000倍)的AIE探针。
3. 近红外二区双光子激发策略降低生物自发荧光的干扰
生物体系错综复杂,充斥着众多自发短波长荧光的内源性物质。因此,可见光激发、可见光发射的荧光探针在进行生物成像时易受到自发荧光的干扰,造成成像的分辨率降低。将激发波长红移至近红外二区 (NIR-II, 1000 ~ 1700 nm)以实现双光子成像可以尽可能地降低生物自发荧光的干扰以及提高成像深度。然而, NIR-II可激发荧光团由于其不可避免的大共轭性和高疏水性,在应用于生理环境时容易形成聚集体, 聚集过程会引起荧光猝灭效应。
4. 聚集诱导发光策略提高荧光团的发光亮度
聚集诱导发光 (AIE) 材料的发展为解决生物体系荧光团的荧光猝灭问题做出了重要贡献。AIE荧光团(AIEgens)由于受到分子内运动的限制,在非聚集状态下不发光或发光微弱,在聚集体状态下能产生高荧光发射. 此外,疏水AIEgens在生物体系中形成的有机聚集体可以克服传统染料在细胞中无规则扩散的问题,为长期跟踪提供持久稳定的荧光信号。因此,开发NIR-II可激发的双光子AIEgens在设计高信背比肿瘤成像的可激活探针方面具有巨大潜力。
5. 扭曲分子内电荷转移策略实现探针理想荧光猝灭态
AIE策略使荧光团在聚集体状态下呈现明亮的荧光。另一方面,探针自身在未被GGT激活前需要一个理想的荧光猝灭态。扭曲分子内电荷转移(TICT)是各种探针中常用的猝灭策略。吡啶和喹啉结构是TICT分子常用的受体。当构建此类可激活探针时,探针被激活后生成的荧光团往往具有削弱的TICT 效应,致使荧光增强,从而实现荧光的OFF-ON转变。然而,探针本身也可以形成聚集体导致严重的分子间相互作用,从而阻碍了TICT过程,造成探针本身也是明亮的AIEgens,不利于设计高信背比的可激活探针。最近的研究表明,甲氧基能有效地诱导AIEgens保持荧光猝灭态。
探针设计
design
本文作者以4, 4-二甲氧基二苯胺为电子给体,吡啶盐为电子受体,合成了两例GGT响应探针OTBP-G和ODBP-G。与使用二苯胺作为供体的研究相比,4, 4-二甲氧基二苯胺与吡啶盐的结合可以显著地猝灭探针的荧光。尽管与水溶性ODBP-G相比,OTBP-G 相对疏水,但由于系间窜越 (ISC)过程,OTBP-G仍然保持极低的背景信号。这种TICT和 ISC过程的协同效应可能是由OTBP-G中有效的电荷分离引起的。经GGT水解后,两种探针可分别生成 NIR-II可激发的AIEgens OTBP和ODBP。更重要的是,由于释放的荧光团OTBP 具有更强的AIE效应,OTBP-G具有更高的荧光增强比例, 其识别GGT后产生的荧光团的荧光发射比OTBP-G的背景信号亮1000倍。(图1)
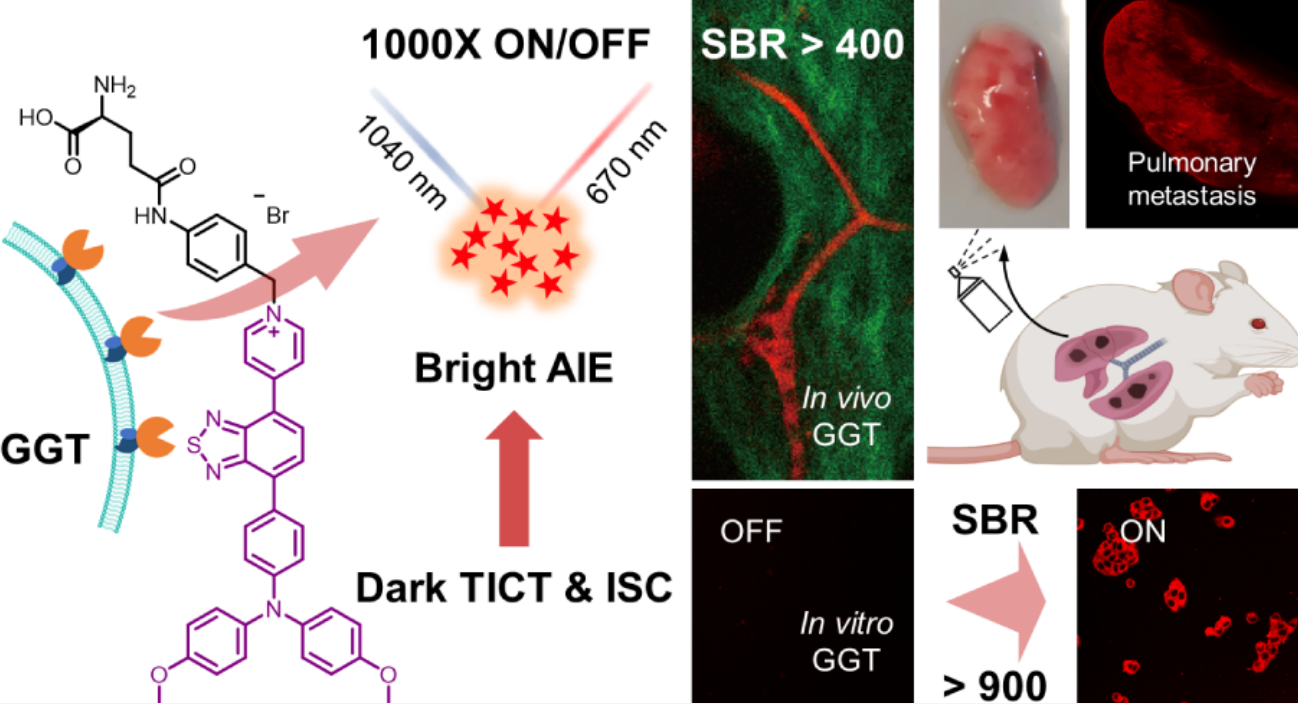
图1 探针的设计与生物应用概念图
RESULTS
•
✦
研究结果
✦
•
基本信息描述
1.探针OTBP-G在体外能够以高信背比响应GGT 探针OTBP-G在 DMSO 溶剂中几乎没有荧光发射,但在加入水后,其荧光发射也没有明显增强,表明 TICT 效应成功地抑制了其荧光发射。OTBP-G无论作为单分子还是聚集体,其荧光信号都可以忽略不计。与荧光团OTBP聚集体相比,OTBP-G探针的荧光强度减弱约1000倍,表现出超高的OFF/ON效应。(图2) 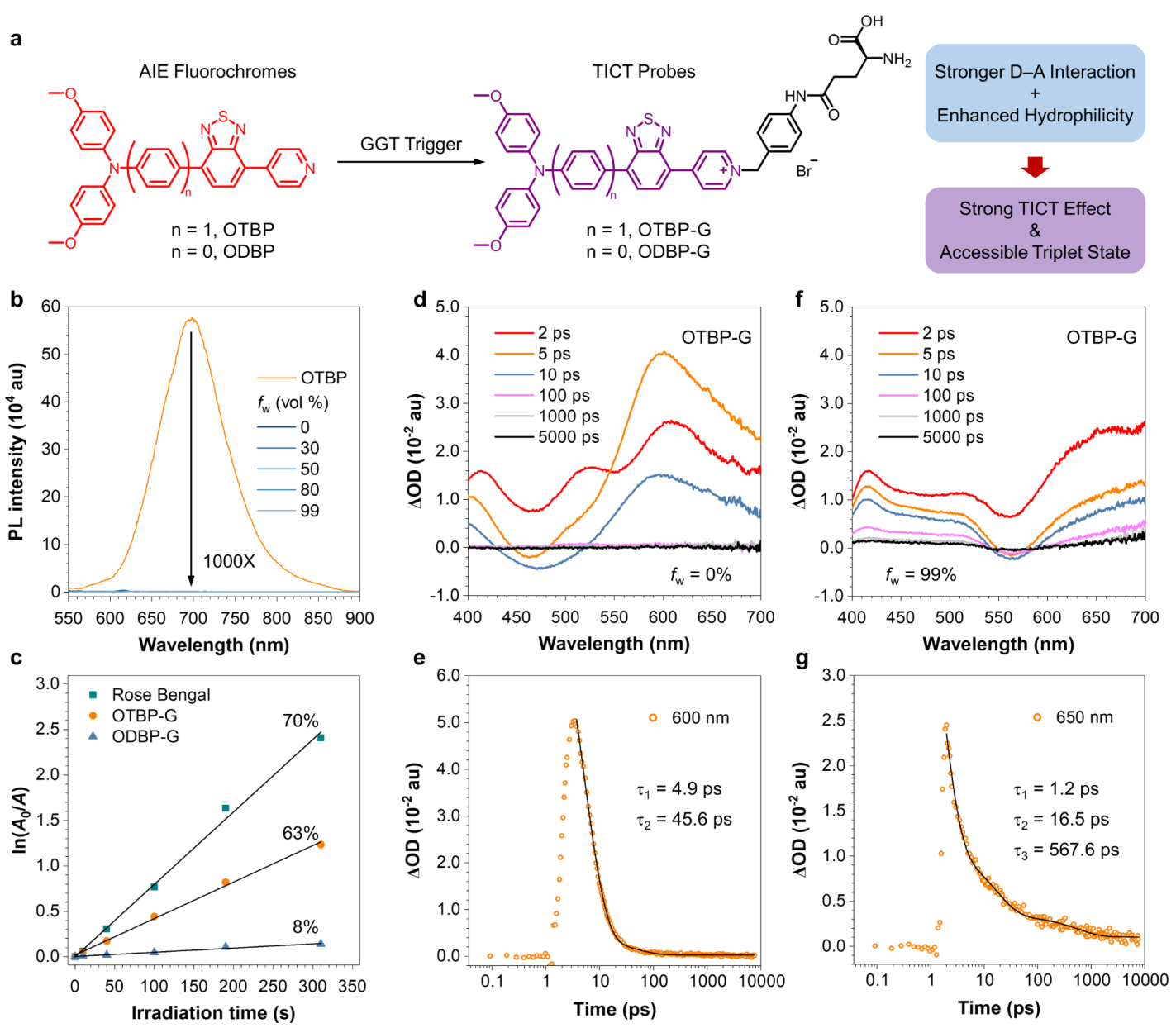 图2 荧光团的光物理性质 OTBP-G在GGT酶的催化下可以生成相应的AIE荧光团OTBP,并发出明亮的荧光信号。在0 ~ 25 U/L范围内,650 nm处的荧光强度与GGT浓度之间存在良好的线性关系。OTBP-G的检出限为0.54 U/L, 具有较高的检测灵敏度。通过动力学计算得到OTBP-G的表观Km为5.84 μM,在已报道的探针中较低。(图3) 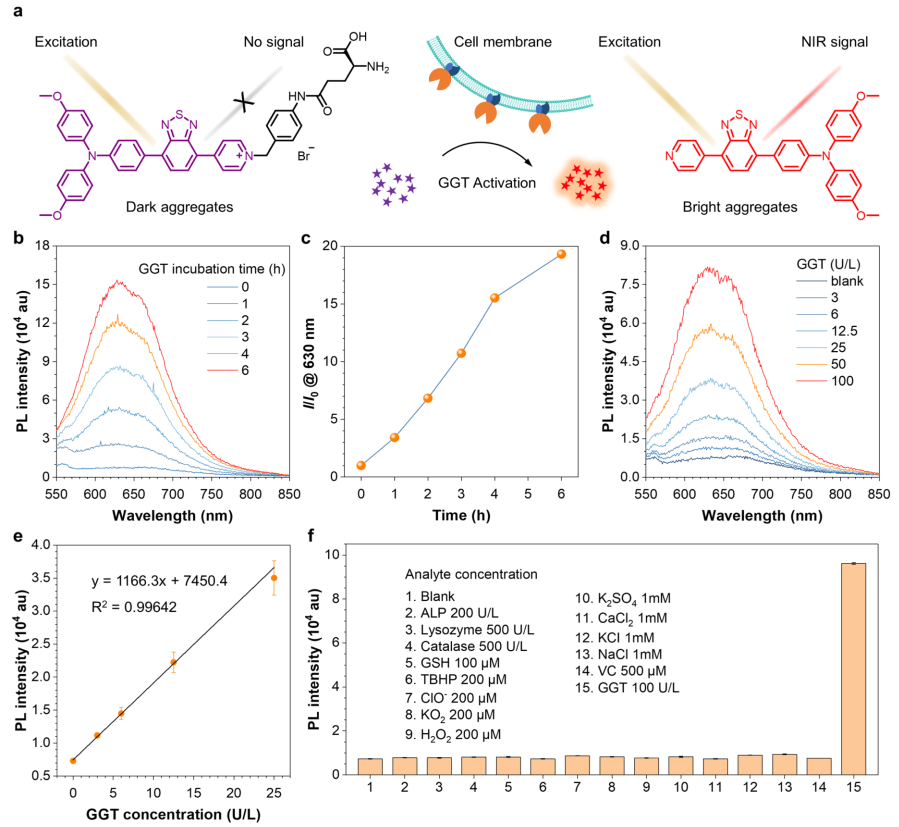 图3 探针的光谱响应表现 2. OTBP-G可以在体外区分癌细胞和正常细胞 探针OTBP-G在GGT高表达的肿瘤细胞(HepG2、4T1细胞)中表现出明显的荧光增强效应,而 GGT 低表达的正常细胞(HUVEC、NIH-3T3细胞)则没有明显的荧光信号,表明探针均可以区分癌细胞与正常细胞。此外,OTBP-G可以在共培养环境中区分 GGT 高表达的癌细胞(4T1细胞)和 GGT 低表达的正常细胞(NIH-3T3细胞)。 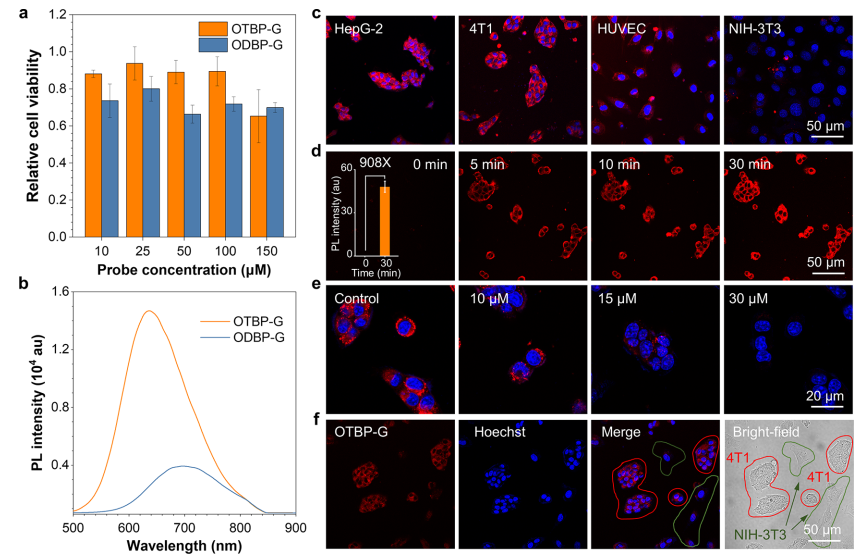 图4 探针在体外区分正常细胞和癌细胞 |
3.OTBP-G 在小鼠血管中快速激活 最初,血管显示出最小的背景自身荧光。然而,静脉注射OTBP-G 后60秒左右,血管造影变得清晰可见。在300s 的过程中,荧光强度逐渐增加。在300s时,SBR达到392。荧光信号在注射后30min达到峰值,SBR超过400。(图5) 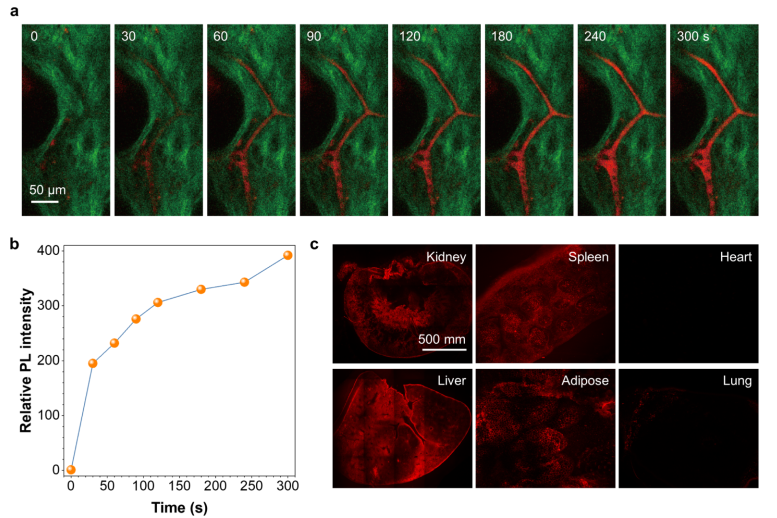 图5 OTBP-G 在小鼠血管中的成像表现 4. OTBP-G 清晰地显示原位乳腺癌部位 为了探索OTBP-G在实际临床应用中的潜力,作者首先使用原位乳腺癌模型对探针进行了评估。与传统的皮下肿瘤模型相比,原位肿瘤模型可以更好地模拟原始肿瘤微环境,对实际应用具有较高的代表性。结果显示,OTBP-G探针在瘤内注射后可快速、清晰显示肿瘤生长部位,而在健康小鼠中,皮下注射OTBP-G后没有观察到明显荧光信号。此外,在肿瘤切片中,OTBP-G 的荧光强度在 GGT 抑制剂处理后显著降低,证明了探针对GGT的特异性检测与成像。(图6) |
5.OTBP-G 可以检测到早期肺转移,早于 H&E 染色 在临床肿瘤学中,发生肺转移是乳腺癌严重的预后事件。因此,早期发现肺转移可以帮助外科医生提前制定治疗方案,改善癌症治疗预后。作者利用荧光探针OTBP-G检测肿瘤转移。通过静脉注射 4T1细胞建立肺转移模型。小鼠在每次转移过程中被处死,取完整肺组织,OTBP-G喷涂并进行双光子成像。OTBP-G在转移的第3天发现肺中 GGT表达升高。值得注意的是,此时肿瘤在苏木精 和伊红染色(H&E)上尚未出现明确的症状,这表明 OTBP-G与传统方法相比,可以更灵敏地区分肺转移的过程。通过对不同时间点肺部荧光强度的统计分析,发现荧光强度与肺转移的进展呈正相关,可用于肺转移的分期。(图6) 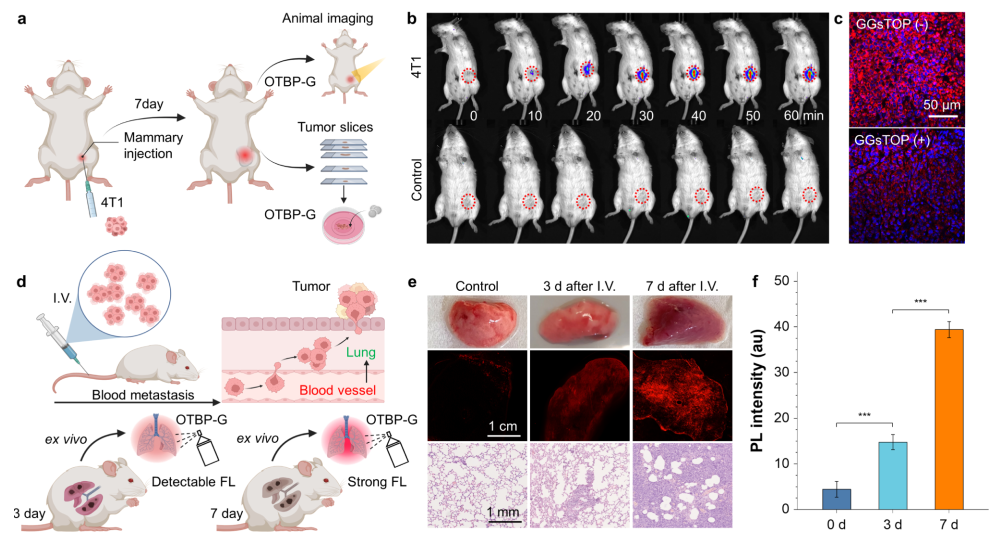 |
图6 探针在原位肿瘤模型和肺转移模型中的成像表现
DISCUSSION
•
✦
研究讨论
✦
•
研究局限性 虽然 OTBP-G 探针在 GGT 检测和成像方面展现出优异的性能,但仍存在一些局限性需要进一步改进: 尽管 OTBP-G 具有极高的 ON/OFF 比率,但释放出的 OTBP 荧光团的荧光量子产率仍有提升空间。提高 OTBP 的荧光亮度将进一步提高探针的灵敏度。 目前的研究主要集中在近红外二区激发的 TICT 探针,而近红外二区发射的探针在肿瘤成像方面更具优势。由于近红外二区发射探针通常具有更大的共轭结构和更差的亲水性,因此实现满意的 ON/OFF 比率更具挑战性。未来需要进一步探索如何优化 AIE 和 TICT 效应,以开发高性能的近红外二区发射探针。 尽管 OTBP-G 在动物模型中表现出良好的 GGT 检测性能,但仍需进一步探索其在人体组织样本中的应用。 目前 OTBP-G 主要用于 GGT 的检测和成像,未来可以探索其多功能性,例如开发双锁探针,以进一步提高探针在复杂生物环境中的特异性和抗干扰能力。 |
参考文献
[1] Hanchen Shen, Lidong Du, Changhuo Xu, Bingzhe Wang, Qingqing Zhou, Ruquan Ye, Ryan T. K. Kwok, Jacky W. Y. Lam, Guichuan Xing, Jianwei Sun, Tzu-Ming Liu, and Ben Zhong Tang, A Near-Infrared-II Excitable Pyridinium Probe with 1000-Fold ON/OFF Ratio for γ‑Glutamyltranspeptidase and Cancer Detection,ACS Nano 2024.
PROFILE
唐本忠教授
香港中文大学(深圳)教授
理工学院院长
中国科学院院士
亚太材料科学院院士
发展中国家世界科学院院士
国际生物材料科学与工程学会联合会会士

唐本忠教授的主要研究领域包括:
聚集诱导发光 (AIE): 唐教授是AIE现象的发现者,并对其进行了深入研究,包括AIE分子的设计、合成、性质和应用等。
光功能材料: 致力于开发具有特定光物理和光化学性质的材料,用于光电器件、生物成像、光动力疗法等领域。
纳米材料: 研究纳米材料的合成、表征和应用,包括纳米药物、纳米传感器、纳米催化剂等。
生物成像: 开发新型荧光探针和成像技术,用于生物分子的检测、细胞成像、肿瘤成像等。
光动力疗法: 研究新型光敏剂和光动力疗法,用于肿瘤治疗。
目前已发表超过1500篇论文,其研究成果被引用超过11.3万次,H指数达到151。自2014年起,Clarivate Analytics将他列为化学和材料科学领域的高被引学者。他曾获得国家自然科学奖一等奖(2017年)、何梁何利基金会的科技进步奖(2017年)等多项荣誉。目前,他担任Wiley出版社出版的Aggregate期刊的主编。
END
文案 | 陆细刚
排版 | 陆细刚
审核 | 陆细刚
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
我们期待你的加入
RECRUIT
投稿联系:
欢迎加入世界生命科学大会,探索生命医学新未来。
添加微信请备注(单位-专业-姓名)

