
INTRODUCTION
•
✦
研究介绍
✦
•

研究背景
Background
胰腺导管腺癌(PDA)是一种侵袭性恶性肿瘤,通常在癌症晚期诊断出来。PDA细胞的特点是多种代谢紊乱导致活性氧(ROS)升高。通过多种机制促进癌变,包括半胱氨酸/蛋氨酸氧化、基因组不稳定和基质相互作用改变,但癌细胞会小心控制ROS水平,以避免有毒物质的积累。对细胞死亡的耐受性是癌症的一个公认的标志,它有助于肿瘤的发生和治疗耐药性。越来越多的证据表明,ROS信号可以决定对非凋亡形式的程序性细胞死亡的敏感性,如程序性死亡和铁死亡。
PDA细胞重组细胞器功能,导致铁利用率和ROS产生显著增加。这增加了细胞对铁致死亡的内在易感性,这种易感性被各种抗氧化机制所抑制,除非环境因素破坏防御系统的稳定。其中,谷胱甘肽过氧化物酶4 (GPX4)在其中起着最关键的作用,这是一种含硒半胱氨酸的蛋白(硒蛋白),它利用还原型谷胱甘肽(GSH)作为辅助因子来解除脂质过氧化。由于明显缺乏转录调控,尽管其疗效不稳定且毒性升高,但仍可用于癌症治疗。诱导铁死亡已被证明可以抑制PDA的体外和体内生长,尽管也有相反的效果报道。
在生物体中,硒(Se)是一种微量元素,尽管存在硫,但仍能与半胱氨酸结合,生成硒代半胱氨酸。目前在人体中仅鉴定出25种硒蛋白,其中大多数与氧化还原稳定有关。硒的摄取和代谢影响铁死亡的易感性。细胞代谢途径参与了ROS相关铁死亡的防御。其中,甲羟戊酸途径(MVP)在PDA中上调,并产生一些自由基捕获类异戊二烯,减轻氧化应激。
MVP限速酶是一类高度选择性的药物,称为他汀类药物。尽管他汀类药物被广泛使用,但其抗肿瘤特性尚不清楚。更重要的是,他汀类药物的使用对癌症患者的益处微小,并且在体内不能充分引发治疗相关的肿瘤细胞死亡。在这里,我们扩展了先前的研究结果,并证明他汀类药物能升高PDA细胞中的ROS,并促进铁死亡。然后,我们发现了一种有机硒化合物,二苄基二硒化物(DBDS)作为一种铁死亡诱导剂,能够在体外和体内抑制PDA的生长。
铁死亡(Ferroptosis):是一种新型程序性细胞死亡形式,为铁依赖性脂质过氧化物的积累所导致。铁死亡发生机制主要与铁代谢紊乱、氨基酸抗氧化系统失衡、脂质过氧化物集聚有关。
RERULTS
•
✦
研究结果
✦
•
1、甲羟戊酸途径抑制诱导铁死亡
甲羟戊酸下游的多种中间体可以稳定氧化还原应激(图1B)。而他汀处理的PDA细胞中ROS的产生。辛伐他汀大量诱导细胞质和线粒体氧化还原物种(图1A-B),而添加甲羟戊酸完全抑制ROS升高(图1D)。这些发现表明,甲羟戊酸途径在PDA中持续存在,以控制ROS水平。另一方面,辛伐他汀处理的PDA细胞表现出强烈的脂质过氧化,通过补充甲羟戊酸和CoQ使其正常化(图1C-S)。

图 1 甲羟戊酸途径的抑制触发PDA氧化应激和铁死亡
2、有机硒化合物在体外表现出抗肿瘤的特性
与正在进行感染性和自身免疫性疾病II/ III期临床试验的Ebselen或新合成的PhSeZnCl相比,DBDS显示出更强的抑制肿瘤细胞生长的能力(图2。有趣的是,这与改变细胞内硒的可用性无关,因为添加低微摩尔浓度的无机硒不会抑制-而是促进-细胞生长。总的来说,这些结果表明DBDS是一种具有有效的抗肿瘤活性,但尚不清楚。
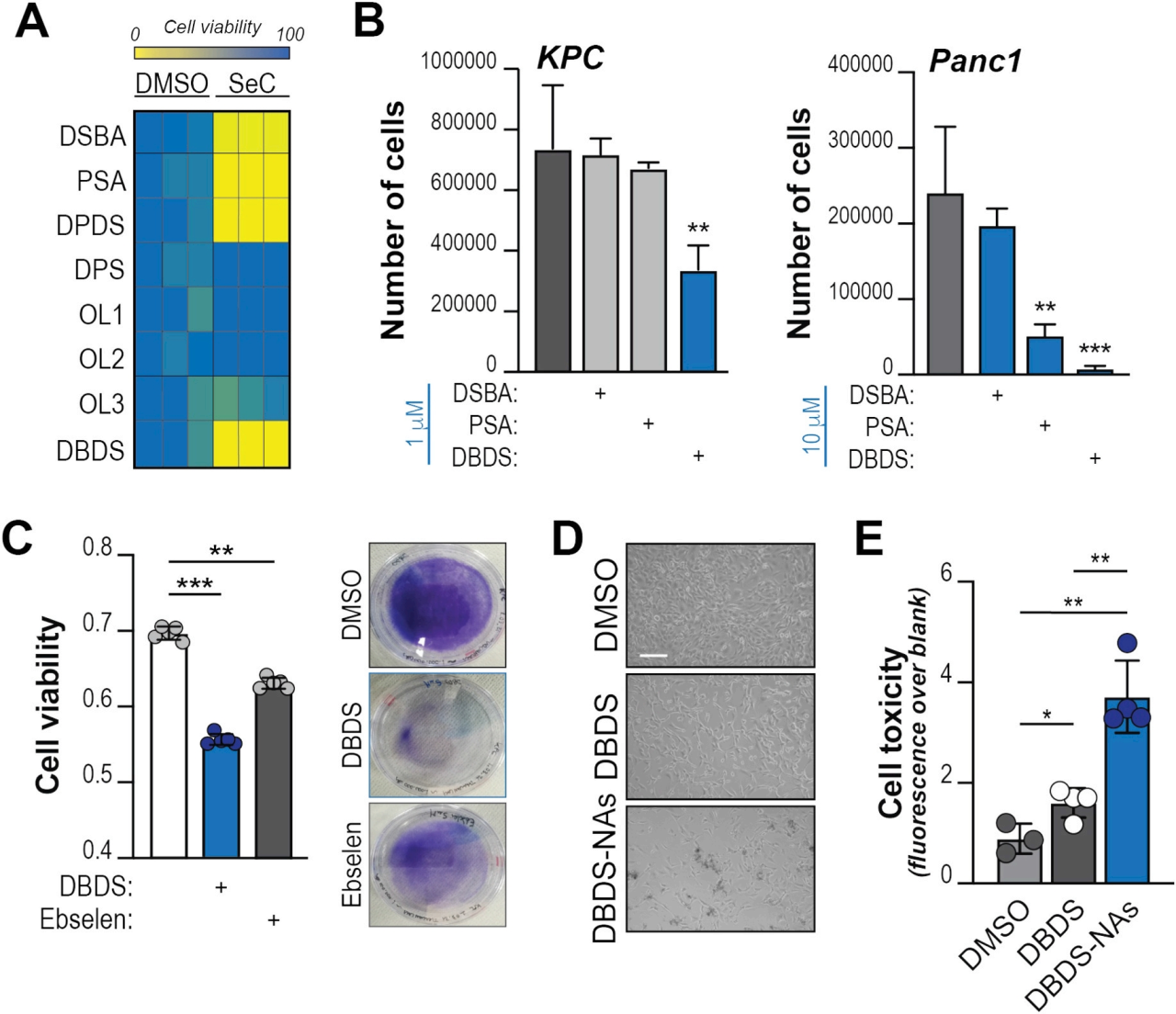

图 2 Dibenzyl diselenide 是一种抗肿瘤化合物。
3、DBDS诱导PDA细胞铁死亡
结果观察到DBDS处理后红到绿的剂量依赖性荧光位移,这可以通过Ferrostatin-1或Anti-oxidant N-acetylcysteine (NAC) 共同处理来阻止(图3A)。这些数据表明,DBDS会引起PDA的铁死亡。
他汀类药物可以靶向细胞的“调节半影区”诱导铁死亡,而DBDS则直接攻击触发铁死亡的核心机制。由于这两种化合物在复杂的生化谱的相反边缘起作用,我们预计DBDS和辛伐他汀的联合治疗可能对细胞死亡具有附加作用,也许是协同作用。事实上,联合给药协同作用导致体外细胞活力降低(图3E),并显著降低体内肿瘤生长(图3F)。在PDA细胞中的发现表明,二硒化物是一种新的铁死亡诱导剂,而MVP中间体是关键的铁死亡屏蔽抗氧化剂。
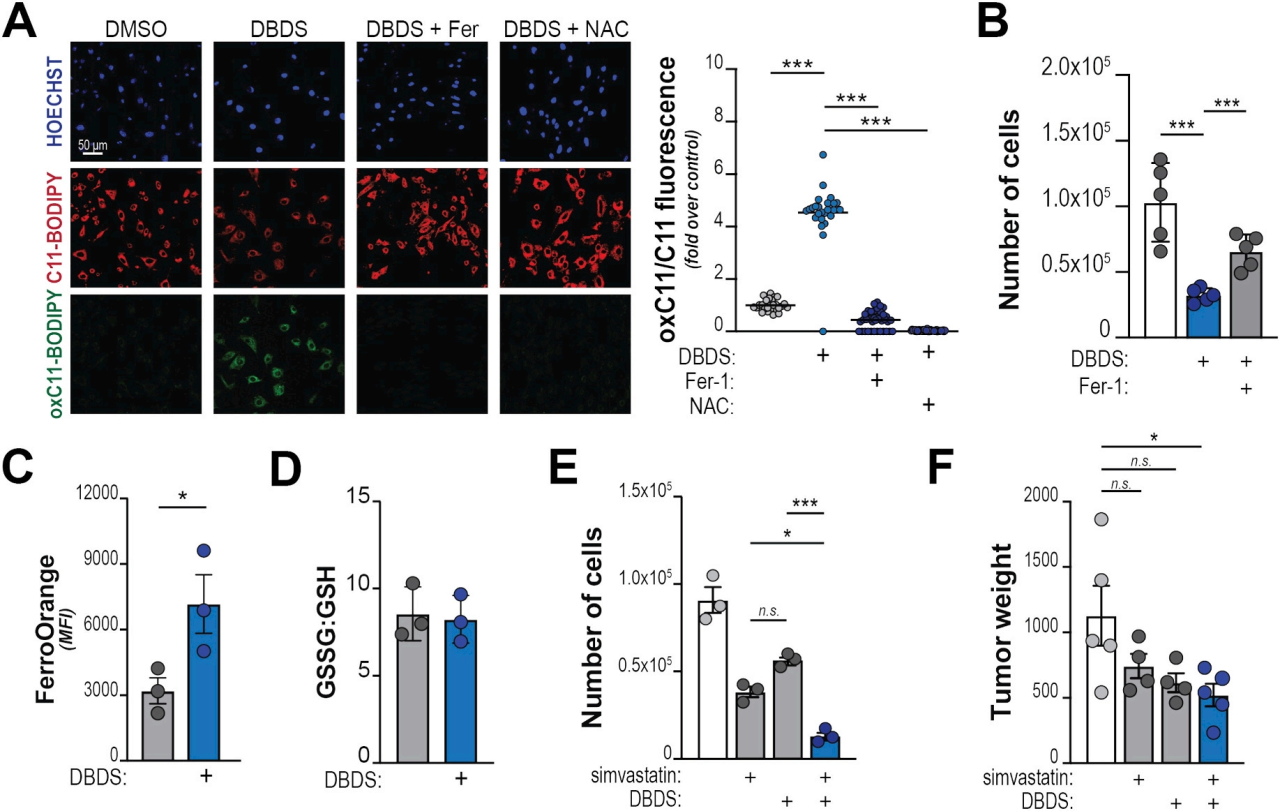
图 3 DBDS是一种铁死亡诱导
Conclusions
•
✦
总结
✦
•
该研究确定了PDA细胞中的代谢脆弱性,可以通过他汀类药物和双硒酸盐的组合攻击。这种概念验证策略取决于铁死亡的内在生化可塑性,培养其核心执行者(例如:铁可用性,活性氧),同时破坏监管防御系统(自由基捕获异戊二烯类)。并发现了含硒有机化合物的新性质,这些化合物代表了设计新型特异性铁死亡诱导剂。
参考文献
[1] Organic Selenium induces ferroptosis in pancreatic cancer cells Noè R, Inglese N, Romani P, Serafini T, Paoli C, Calciolari B, Fantuz M, Zamborlin A, Surdo NC, Spada V, Spacci M, Volta S, Ermini ML, Di Benedetto G, Frusca V, Santi C, Lefkimmiatis K, Dupont S, Voliani V, Sancineto L, Carrer A. Organic Selenium induces ferroptosis in pancreatic cancer cells. Redox Biol. 2023 Dec;68:102962. doi: 10.1016/j.redox.2023.102962. Epub 2023 Nov 20. PMID: 38029455; PMCID: PMC10698006..
END
文案 | 蒋蒋
排版 | 蒋蒋
审核 | 蒋蒋
发布|姜笑南
世界生命科学大会

RECRUIT
关注我们,获取生命科学
学界前沿|促进更多的学术交流与合作
业界前沿|促进更快的产品创新与应用
政策前沿|促进更好的治理实践与发展
我们期待你的加入
RECRUIT
投稿联系:
欢迎加入世界生命科学大会,探索生命医学新未来。
添加微信请备注(单位-专业-姓名)

